Standard Location of 14 Meridian's Points

ЗМІСТ
СПИСОК СКОРОЧЕНЬ
|
АГ АП АТ ВББ ВРС ВСА ГДЕ ГРТ ГХ
ДАТ ДКІ ДСІ ЕЕГ ЗМА ЗСА КА КТ ЛП ЛШК МРТ НА НІЛВ ОА ОФЕКТ РЕГ РеоІ САТ СМА ССС УЗДГ ХА ХМ АТ ЦНС PI RI Vd Vm Vs ЧСС
|
артеріальна гіпертензія акупунктура артеріальний тиск вертебробазилярний басейн варіабельність ритму серця внутрішня сонна артерія гіпертонічна дисциркуляторна енцефалопатія голкорефлексотерапія гіпертонічна хвороба діастолічний артеріальний тиск дисциркуляторна енцефалопатія дикротичний індекс діастолічний індекс електроенцефалографія задня мозкова артерія загальна сонна артерія коефіцієнт асиметрії комп’ютерна томографія лазеропунктура лінійна швидкість кровотоку магнітно-резонансна томографія надблокова артерія низькоінтенсивне лазерне випромінювання основна артерія однофотонноемісійна комп’ютерна томографія реоенцефалографія реографічний індекс систолічний артеріальний тиск середня мозкова артерія серцево-судинна система ультразвукова доплерографія хребтова артерія холтерівський моніторинг артеріального тиску центральна нервова система індекс пульсації індекс периферичного опору кінцева діастолічна швидкість кровотоку середня швидкість кровотоку за цикл максимальна систолічна швидкість кровотоку частота серцевих скорочень |
Вступ.
Судинні захворювання нервової системи – одна з основних проблем сучасної та, як показують прогнози, майбутньої медицини. Значна розповсюдженість судинних захворювань нервової системи, складність та стійкість порушення функцій, що супроводжуються тривалою, а часто і стійкою втратою працездатності, ставлять проблеми лікування та реабілітації цієї патології в ранг найважливіших медико-соціальних проблем охорони здоров’я.
На сьогоднішній день безперечним залишається той факт, що частка цереброваскулярної патології в структурі загальної захворюваності є досить вагомою і займає одне із перших місць за показниками смертності і, згідно з даними ВООЗ, становить 11,3% від загальної смертності населення (Одинак М.М. и соавт., 1997). Так у світі щорічно захворюють на інсульт більше 7 млн. людей і майже 4,5 млн. від нього помирають (Міщенко Т.С., 2006).
Актуальною ця проблема і є для України, адже смертність від цереброваскулярної патології посідає друге місце в структурі загальної смертності. Слід зауважити, що поширеність цереброваскулярних захворювань в Україні зростає, так якщо у 1995році цей показник складав 4526,8 на 100 тис. населення, то у 2004 році цей показник збільшився у 1,8 разів і становить 7873,5 на 100 тис. населення. Більша половина даної патології зумовлена артеріальною гіпертензією. Збільшення цього показника в нашій країні спостерігається за рахунок хворих на дисциркуляторну енцефалопатію (ДЕ). У 2004 році в Україні зареєстровано 2,8 млн. хворих з цією патологією (Міщенко Т.С., 2006). Дана тенденція обумовлена збільшенням розповсюдженості артеріальної гіпертензії, атеросклерозу, як основних етіологічних чинників ДЕ.
Актуальність цієї проблеми визначається і її соціальною значимістю: неврологічні та психічні розлади при хронічній судинній патології можуть стати причиною тяжкої інвалідності хворих. Основною причиною такого стану є не тільки недосконалість ранньої діагностики, а й не завжди правильно підібране лікування, яке б враховувало індивідуальні особливості організму людини.
Питання терапії хронічної цереброваскулярної патології висувається на одне із перших місць в сучасній ангіоневрології, що пов’язано з однієї сторони з тим, що дана патологія є фактором ризику розвитку інсультів, а з іншої – причиною поступового наростання неврологічних та психічних розладів, що істотно погіршує якість життя, а нерідко знижує працездатність (Верещагин Н.В., Азов Е.И., 1996; Манвелов Л.С., Кадыков А.С., 2000; Винницкий А.Г. и соавт., 2002). Отже, основним напрямком боротьби з важкими медичними та соціальними наслідками цереброваскулярної патології є рання доклінічна діагностика та попередження подальшого прогресування судинних дизгемій (Суслина З.А., Варакин Ю.Я., Верещагин Н.В., 2006). Ось чому питання ефективного та адекватного лікування ДЕ є одним із пріоритетних на теперішньому етапі розвитку неврологічної науки. Висока ступінь виникнення цереброваскулярної патології на фоні артеріальної гіпертензії (Амосова Е.Н., 1997; Арабидзе Г.Г., 1999) ставить завдання пошуку патогенетично спрямованого лікування цієї патології.
При розгляді основних тенденцій до лікування ДЕ звертає на себе увагу громіздкість лікувальних схем, а також значна їх коштовність. Тому попередження подальшого розвитку судинних розладів мозкового кровообігу залишається актуальним і потребує подальшого вивчення (Суслина З.А., Варакин Ю.Я., Верещагин Н.В., 2006). Враховуючи вище викладене, розробка принципово нових методів лікування даної патології є актуальним напрямком сучасної медицини. Все це зумовило необхідність пошуку немедикаментозних методів лікування, зокрема з використанням рефлексотерапії.
Розділ 1. Етіопатогенез гіпертонічної дисциркуляторної енцефалопатії.
1.1. Епідеміологія і класифікація артеріальної гіпертензії.
Термін ДЕ був запропонований в 70-х роках минулого століття видатними неврологами Е. В. Шмідтом і Г. А. Максудовим для позначення хронічної прогресуючої недостатності мозкового кровообігу. В нашій країні термін ДЕ став широко застосовуватись після затвердження класифікації судинних захворювань головного мозку на пленумі наукового товариства по неврології в 1984 році. Згідно з пояснень до цієї класифікації, ДЕ виникає внаслідок повільно прогресуючої недостатності мозкового кровообігу, що веде до розвитку множинних дрібноосередкових або дифузних уражень мозку і обумовлює розвиток порушення функції головного мозку. В Міжнародній класифікації хвороб (МКХ) 10-го перегляду термін ДЕ відсутній. Слід відмітити, що закордоном хронічні форми церебровскулярної патології зводять переважно до судинної деменції, яку патогенетично зв’язують лише з інсультами.
В МКХ-10 є декілька рубрик, які відповідають описанню ДЕ: I67.2 — церебральний атеросклероз; І67.3 — прогресуюча судинна лейкоенцефалопатія (хвороба Бінсвангера); I67.4 — гіпертензивна енцефалопатія; І67.8 — хронічна ішемія мозку. Якщо хвороба Бінсвангера являє собою самостійну нозологічну одиницю, то хронічна ішемія мозку — це синдром, клінічні прояви якого можуть варіювати від легких неврозоподібних порушень до вираженого неврологічного дефекту або деменції.
Центральна нервова система – це особливий орган, який потребує систематичного та безперешкодного постачання крові. Чим вище диференційована тканина, тим чутливіша вона до порушень трофіки. Саме тому розлади мозкового кровообігу і, як наслідок, дисбаланс трофіки нейронів одразу впливають на функції всієї нервової системи, що виражається структурною і функціональною неповноцінністю її клітин (Поливода С.Н., Шальмина М.А., Соловьюк А.О., 2006).
Діагноз ДЕ встановлюється при наявності основного судинного захворювання та розсіяних осередкових неврологічних симптомів в поєднанні із загальномозковими. Вище вказана патологія – це поліетіологічна нозологічна група, що характеризується хронічним перебігом, в основі патогенезу якої лежить судинна та лікворна дисфункція (Мачерет Є.Л., Галич В.В., 2005; Тодуа Ф. И., 2005).
Найбільш частими етіологічними факторами ДЕ є: атеросклероз (слід відзначити, що цукровий діабет, прискорює динаміку розвитку атеросклерозу), артеріальна гіпертензія (АГ) та поєднання атеросклерозу й гіпертензії. Рідше вона обумовлена церебральним ревмоваскулітом, венозною недостатністю, хворобами крові.
Як відомо, мозковий кровообіг являє собою самостійну функціональну систему з багаторівневими механізмами ауторегуляції й певними особливостями морфологічної будови (Верещагин Н.В., Суслина З.А., Максимов М.Ю., 2004). Поняття ауторегуляції означає спроможність судинної системи головного мозку (ГМ) підтримувати середній кровотік на постійному рівні, незалежно від змін рівня артеріального тиску (АТ), а також змінювати його згідно з потребами мозкової тканини. Вся складна система регуляції мозкового кровообігу орієнтована на забезпечення та збереження незалежності й постійності мозкового кровообігу, що забезпечує характерну для мозку високу інтенсивність метаболізму. Регуляція цереброваскулярних механізмів здійснюється високоорганізованою фізіологічною системою до складу якої входять магістральні, внутрішньомозкові артерії та вени, піальні артерії та артерії м’якої мозкової оболонки. Однією із основних причин порушення ауторегуляції є зміна системного АТ.
АГ - одна із найпоширеніших нозологій. За статистичними даними МОЗ України у 2003 році зареєстровано понад 9,8 млн. людей з АГ в Україні, що становить 24,3% дорослого населення (Свіщенко Є.П., 2003).
Однак, все ще зберігаються певні розбіжності між даними офіційної статистики і результатами епідеміологічних досліджень, які показують, що частина хворих з підвищеним АТ в Україні залишається невиявленою. Так, дослідження, проведені інститутом кардіології ім. М.Д.Стражеска, виявили, що підвищений АТ (> 140/90 мм. рт. ст.) мають майже 44% дорослого населення. Така ж розповсюдженість реєструється і в інших європейських країнах та США. Зростання цього показника на 81% у порівнянні з 1997 і на 53% порівняно з 1999 роком свідчить про позитивну тенденцію, яка є наслідком ефективної роботи по виявленню цієї патології. Одночасно з цим, зростання показника поширеності АГ супроводжується стабільним зниженням захворюваності на інсульти в Україні - у порівнянні з 1998 роком на 12%, що свідчить про більш ефективну боротьбу з наслідками АГ (Свіщенко Є.П. і співавт., 2005). Стандартизований за віком показник поширеності АГ серед працездатного населення України становить 34,1%: серед чоловіків – 34,7%; серед жінок – 33,4%. Серед осіб з підвищеним АТ знають про наявність захворювання 46,9% сільських і 85,1% міських жителів, лікуються відповідно 12,4% та 61,2%, з них ефективно – 6,2 та 20,5%.
Варто зауважити, що ризик судинних ускладнень АГ тісно корелює з рівнем АТ (Rashid P., Leonardi-Bee J., Bath P., 2003). Чим вищий АТ, тим вищий ризик розвитку інсульту, передчасної смерті.
АГ – це постійно підвищений систолічний та/чи діастолічний АТ. Відповідно до останніх рекомендацій Європейського товариства гіпертензії та Європейського товариства кардіології (2003р) розрізняють декілька рівнів АТ, які зображені в таблиці 1.
Таблиця 1.
Класифікація рівня АТ
Категорія |
Систолічниймм.рт.ст. |
Діастолічний мм.рт.ст. |
|
Оптимальний |
< 120 |
< 80 |
|
Нормальний |
< 130 |
<85 |
|
Високий нормальний |
130 – 139 |
85 - 89 |
|
Ступінь 1 (м’яка АГ) |
140 – 159 |
90 - 99 |
|
Ступінь 2 (помірна АГ) |
160 – 179 |
100 - 109 |
|
Ступінь 3 (тяжка АГ) |
>180 |
>110 |
Згідно з цією класифікацією, АГ - це підвищення систолічного АТ до 140 і більше мм.рт.ст. або діастолічного АТ до 90 мм.рт.ст. і вище, і якщо таке підвищення є стабільним, тобто підтверджується при повторних вимірюваннях АТ (не менше, ніж 2-3 рази у різні дні протягом 4 тижнів).
Виділяють також злоякісну АГ - синдром, що характеризується швидко прогресуючим підвищенням АТ, розвитком некротичного артеріїту з фібриноїдною дегенерацією, важким ураженням органів-мішеней. Клінічними критеріями є вкрай високий тиск (діастолічний вище 130 мм.рт.ст.) і зміни очного дна по типу нейроретинопатії (набряк соска зорового нерва, крововиливи й ексудати в сітківці). При відсутності лікування протягом найближчих 5 років гине 100% хворих. Антигіпертензивна терапія дозволяє домогтися виживання 65-80% хворих із цим синдромом.
В лікарській практиці використається також класифікація АГ залежно від ураження органів-мішеней. Відповідно до цієї класифікації виділяють три стадії гіпертензії, що характеризуються відсутністю або наявністю ускладнень.
Таблиця 2.
Класифікація АГ в залежності від ураження органів-мішеней
|
Стадія I
|
Об'єктивні ознаки органічних змін відсутні
|
|
Стадія II
|
Є хоча б одна з наступних ознак ураження органів без симптомів з їх боку:
|
|
Стадія III
|
Є не тільки скриті ознаки, але і явні клінічні прояви ураження органів: Серце
Мозок
Очне дно
Нирки
>124 мкмоль/л у жінок; Судини
|
1.2. Основні принципи розвитку патологічних змін при гіпертонічній дисциркуляторній енцефалопатії.
Отже, одним із органів-мішеней при АГ є ГМ, тому внаслідок розвитку патологічного процесу виникає гіпертонічна дисциркуляторна енцефалопатія (ГДЕ).За даними Юршевич Е.А. та Евстигнеева В.В. (2002) у хворих з транзиторними ішемічними атаками АГ зустрічається частіше, ніж у хворих з хронічною ішемією мозку, важливим є те, що тривалість АГ не впливає на характер ішемії: гостре порушення мозкового кровообігу чи ДЕ.
Основним діагностичним критерієм ГДЕ є АГ на протязі 5-10 років, що супроводжується кризами і поступовим погіршенням стану в міжнападовий період (Одинак М.М. и соавт., 1997). ДЕ при гіпертензії виникає внаслідок розвитку судинної дисциркуляції, гемодинамічних зрушень, пов’язаних з гіперемією ГМ, споріднених з гіпоксією (Верещагин Н.В. и соавт., 1997; 1999). Остання на перших етапах може викликати реакції нейродинамічного характеру, а потім індукує структурні зміни в тканинах мозку. Основне значення, у викликаних ішемією змінах, приділяється виходу в екстрацелюлярний простір і взаємодії з відповідними рецепторами нейротрансміттерів, головним чином збуджуючих амінокислот і катехоламінів (Одинак М.М. и соавт., 1997).
ДЕ проявляється морфологічними змінами як в судинах, так і в паренхімі мозку (Бурцев Е.М., 1996). При АГ виявляється плазматичне просмоктування стінок артеріол з їх гіалінозом, часто з утворенням піліарних аневризм. В тканинах мозку утворюються ділянки з ішемічно зміненими нервовими клітинами. Навколо судин, в результаті гибелі нервової тканини, формуються периваскулярні лакуни. ДЕ пов’язана з розвитком дифузних дрібноосередкових змін мозкової тканини, що зумовлює наростання порушень функції ГМ. Отже, анатомічним субстратом ГДЕ є прогресуюча атрофія підкоркової білої речовини півкуль ГМ при відносній інтактності кори.
В результаті досліджень було встановлено, що первинне ушкодження судин ГМ при АГ виникає із-за збільшеного кровотоку під високим тиском, а не внаслідок первинного спазму судин (Зозуля И.С., Алексеева Т.С., 2004). Однак, розвиток фільтраційного набряку мозку приводить до підвищеного внутрішньо-тканинного тиску, із-за чого може стискуватись мікроциркуляторне русло мозкових артерій і виникає ішемія мозку. Найбільш вразливими є прямолінійні артеріо-артеріальні анастомози, які найбільш представлені в потиличній зоні, тому для гіпертонічних кризів характерні потиличні болі та зорові симптоми.
При хронічній експериментальній АГ змінюється архітектоніка кровоносного русла: зменшується просвіт судин внаслідок потовщення їх стінок, дальше облітерується частина артеріол. Спостерігається зменшення числа і діаметру артерій, що приводить до локальної гіпоксії мозку. Це співпадає з клінічними дослідженнями мозкового кровообігу (Винницкий В.А.и соавт., 2002). Важлива роль в зниженні мозкового кровообігу відводиться структурній адаптації судин до довготривалого підвищення АТ спочатку у вигляді гіпертрофії м’язової оболонки, а потім до проліферації сполучнотканинних елементів і склерозу судин, що веде до підвищення ригідності і звуження просвіту судин. Найбільш виражені зміни при АГ спостерігаються в інтрацеребральних артеріях. В них переважають деструктивні зміни, що ведуть до гіпертрофічних стенозів та облітерації артерій. В судинах мікроциркуляторного русла виникає запустіння, фіброз, відбувається утворення конволютів. В екстрацеребральних судинах проходять адаптаційні та деструктивні зміни (Верещагин Н.В., Моргунов В.А., Гулевская Г.С., 1997).
Здатність резистивних артерій до адекватної дилатації зменшується, внаслідок цього зменшується перенесення гіпотензивних навантажень. Навіть незначне зниження АТ може сприяти ішемії тих зон мозку, котрі живляться найбільш зміненими артеріями, нездатними розширюватися. За ішемією мозку в подальшому настають різкі гіпертонічні епізоди і поступово накопичуються дистрофічні зміни мозкової тканини.
Слід підкреслити, що в одній і тій же судині нерідко зустрічаються зміни, що виникли гостро і патологічні процеси, які мають певну давність. Це свідчить про безперервність та періодичність змін в судинній стінці при АГ (Верещагин Н.В., Моргунов В.А., Гулевская Г.С., 1999).
Різке підвищення АТ (церебральний криз) у хворих з АГ являє собою додатковий фактор ризику розвитку церебральних і соматичних ускладнень і потребує в більшості випадків невідкладної допомоги. З розвитком АГ, з кожним наступним гіпертонічним кризом в патологічний процес включається додаткова область мозку. Артерії, в яких відбувся зрив ауторегуляції і пасивне розтягнення, зазнають незворотних змін при тривалому впливі високого АТ, тобто більше 20 хвилин.
При довготривалому підвищенні АТ зміни відбуваються в сонних та хребтових артеріях, порушується їх еластичний каркас, відбувається фрагментація внутрішньої еластичної мембрани та деструкція м’язового шару, гинуть м’язові волокна. В результаті цього артерії подовжуються, розширюються, стають звивистими. Потім вони деформуються, виникають перегини та септальні стенози, міліарні аневризми, які складають реальну загрозу розриву артерії та крововиливу в мозок (Верещагин Н.В., Моргунов В.А., Гулевская Г.С., 1997, 1999).
АГ, що має кризовий перебіг, веде до порушення проникливості стінок судин, плазморагії, гіалінозу або фібриноїдного некрозу. Завершенням цього патологічного процесу є склероз із звуженням або закриттям просвіту судин. Інший вид деструкції судин полягає в ізольованому некрозі м’язової оболонки артерій без плазморагій. Внаслідок цього в мозку формуються тонкостінні неміцні судини із сегментарними звуженнями та перегинами, що різко порушують кровотік в мікроциркуляторному руслі. Різноманітні за характером ураження мозку прояви, обумовлені зміною судин при АГ, носять назву гіпертонічної ангіоенцефалопатії (Манвелов Л.С., Кадыков А.С., 2000). Відмічаються невеликі крововиливи, на місці яких в подальшому утворюються гліомезодермальні рубці, формуються лакуни. В результаті звуження або закриття просвіту невеликих внутрішньомозкових артерій, що виникають при частих гіпертонічних кризах розвиваються лакунарні інфаркти. Утворення множинних лакун веде до лакунарного стану – важкої патології мозку, обумовленої тривалою та стійкою АГ.
Як говорилось вище, специфічним для АГ є ураження білої речовини півкуль головного мозку, яке зустрічається під терміном „гіпертонічна лейкоенцефалопатія” - лейкоареоз, що характеризується дрібноосередковими й дифузними змінами в білій речовині (Верещагин Н.В., Моргунов В.А., Гулевская Г.С., 1997; Colon AJ., 2000).
Дифузні й дрібноосередкові зміни білої речовини представлені розповсюдженим спонгіозом, що виникає внаслідок довгостроково існуючого набряку й хронічної гіпоксії цієї області мозку; вогнищ повного й неповного некрозу; утворення дрібних порожнин, периваскулярного енцефалолізису й прогресуючої деструкції мієліну нервових волокон. Спочатку ці зміни розвиваються перивентрикулярно навколо передніх рогів бічних шлуночків, поширюючись далі по бічних відділах шлуночків симетрично в обох півкулях мозку. Провідну роль у розвитку лейкоареозу грають наступні фактори: гіпертонічні кризи, нічна гіпертензія, підвищена варіабельність АТ, епізоди ортостатичної гіпотонії, ятрогенна гіпотонія, вік (> 60 років) (Свіщенко Є.П. і співав., 2000; Surikova I; Meisel S; Siebler M; Wittsack HJ; Seitz RJ., 2006). Дифузні зміни часто поєднуються з осередковими змінами в білій речовині (лакунарними інфарктами).
Так як АГ є причиною розвитку ГДЕ, то і характеристики АТ є досить вагомими в розвитку цереброваскулярних розладів. Розрізняють наступні фактори розвитку ГДЕ: неконтрольована АГ, гіпертонічні кризи, висока варіабельність АТ, висока нічна гіпертензія, надмірне зниження АТ, включаючи ятрогенне, високий пульсовий АТ.
Фахівцями НДІ неврології РАМН проведене дослідження добового профілю АТ у хворих з ГДЕ типу Бінсвангера, що виявило різні його порушення: надмірне падіння й підвищену варіабельність АТ в нічні години, порушення добового ритму АТ (Калашникова Л.А., Кулов Б.Б., 2002). Очевидно, відносна гіпотонія при важких ураженнях мозкових судин зі звуженим просвітом збільшує наявну дифузну ішемію глибоких відділів білої речовини ГМ (Гераскина Л.А. и соавт., 2003). Разом з тим у хворих з важкою ГДЕ виявляють порушений добовий ритм АТ з нічною гіпертонією, що викликає додаткове до денних годин пресорне навантаження на судинну систему ГМ.
Однак, за даними багатьох досліджень при ДЕ, що виникла на фоні АГ, спостерігається у 89% венозний застій (Тодуа Ф. И и соавт., 2005), причому клінічні прояви не залежать від віку, тривалості АГ, нейроендокринопатій, а корелюють із ступенем венозного застою, розширенням лікворних шляхів. Ураження брахіоцефальних артерій атеросклерозом або АГ порушує діяльність фізіологічної „артеріовенозної помпи”, викликаючи венозний застій. При прогресуванні процесу відбувається вичерпування компенсаторних адаптаційних можливостей колатерального венозного відтоку, що (особливо при супутній аномалії розвитку в області задньої черепної ямки і венозних синусів) сприяє поглибленню венозної дисциркуляції, підвищенню пульсового тиску ліквору і виникненню доброякісної внутрішньочерепної гіпертензії та гідроцефалії із наступною атрофією головного мозку.
Особливість АГ полягає в тому, що маючи тривалий час безсимптомний або малосимптомний перебіг з епізодичною церебральною симптоматикою, рано або пізно вона ушкоджує судинну систему й речовину головного мозку й поволі формується клінічна картина ГДЕ (Гогин Е.Е., Шмырев В.И.,1997). Провідні нейрофізіологи й неврологи І.В. Ганнушкіна й Н.В. Лебедєва писали: „Є значна невідповідність між даними клініки про перенесені інсульти й наявність великої кількості вогнищ у підкіркових вузлах і білій речовині мозку (по даним комп’ютерної томографії (КТ)) і ще більшим числом вогнищ, що виявляють при патанатомічному дослідженні”.
З неврологічної точки зору перші ознаки декомпенсації на початкових етапах АГ розглядаються як початкові прояви недостатності мозкового кровообігу, а психоневрологічні ознаки на більше пізніх стадіях гіпертензії йменуються „дисциркуляторною енцефалопатією” (Шмидт Е. В., Максудов Г. А., 1971) або „хронічною судинною мозковою недостатністю”. Однак, за кордоном такої нозології як початкові прояви недостатності мозкового кровообігу не розглядають. В Росії було проведено дослідження, що полягало в співставленні клініко-функціональних, морфологічних і нейропсихологічних показників у хворих двох груп: з початковими проявами недостатності кровообігу і ДЕ І стадії, а також здорових людей. Результати обстежень показали односпрямованість змін досліджуваних параметрів і відсутність достовірної різниці в групах, що свідчить про тотожність цих двох груп і недоцільність виносити у класифікацію початкові прояви.
В свою чергу, Бурцев Є.М. (1996) на основі досвіду багаторічного спостереження та комплексного обстеження хворих з ДЕ запропонував її класифікацію з виділенням І (початкової) стадії без дефіцитарної психопатологічної симптоматики, II А и II В стадій з наявністю клінічного скритого або маніфестного нервово-психічного дефекту, III стадії з проявами паркінсонізму, псевдобульбарного синдрому, деменції.
Контрольні питання до розділу.
Pозділ 2. Клініка та діагностика гіпертонічної дисциркуляторної енцефалопатії на різних стадіях її розвитку.
2.1. Клінічні ознаки дисциркуляторної енцефалопатії.
В основі клінічних проявів доінсультних стадій цереброваскулярних захворювань, до яких відносять початкові прояви недостатності мозкового кровообігу та ранні форми ДЕ, лежить недостатнє гемодинамічне забезпечення підвищеної функціональної активності мозку, що можна пояснити неефективністю компенсаторно-пристосувальних реакцій (Волкова И.И. и соавт., 2000).
З врахуванням клінічних проявів розрізняють три стадії ДЕ (Камчатнов П.Р., 2000 та ін.). Перша характеризується розсіяною, легко вираженою симптоматикою ураження мозку: асиметрія носо-губних складок, девіація язика, анізорефлексія та інше. При цьому, як і в хворих з початковими проявами недостатності мозкового кровообігу, часто спостерігаються скарги на головний біль, запаморочення, шум в голові, зниження пам’яті (не професійної) та працездатності. Хворі не зібрані, дратівливі, спостерігається сльозливість, настрій пригнічений, їм важко переключитись з одного виду діяльності на інший. Віддиференціювати цю стадію ДЕ від початкових проявів дозволяє наявність окремих симптомів органічного ураження мозку та стійкість суб’єктивних порушень, які не проходять після відпочинку. У цій стадії захворювання, як правило, ще не формуються виразні неврологічні синдроми, крім астенічного. Астенічний стан при неврозах, на відміну від ДЕ, характеризується значною лабільністю та залежністю від психогенних впливів.
На другій стадії захворювання відмічається прогресування погіршення пам’яті, в тому числі і професійної, звужується круг інтересів, страждає інтелект, змінюється особистість хворого. Характерна денна сонливість при поганому нічному сні. В порівнянні з першою стадією захворювання підсилюються органічні неврологічні симптоми, збільшується їх кількість. Виникають легка дизартрія, патологічні рефлекси, аміостатичні симптоми: брадикінезія, в’язкість м’язового тонусу. Якщо на першій стадії працездатність в основному збережена, то на другій вона значно знижена. Зменшується частота скарг на головний біль та інші прояви астенічного симптомокомплексу. При цьому виразнішою стає осередкова симптоматика у вигляді рефлексів орального автоматизму, координаторних і окорухових розладів, пірамідної недостатності. У цій стадії вже можна виділити домінуючі неврологічні синдроми - вестибуло-атактичний, пірамідний, підкірковий й інші; знижується професійна й соціальна адаптація хворих.
На третій стадії захворювання грубі дифузні зміни мозкової тканини зумовлюють не тільки ріст числа та вираженості органічних симптомів ураження головного мозку та погіршення психічних порушень (аж до деменції), але і розвиток чітких неврологічних синдромів. Характерним для даної стадії є гострі порушення мозкового кровообігу. В цій стадії ДЕ обсяг скарг зменшується, що поєднується із зниженням критичного відношення хворих до свого стану. Зберігаються скарги на зниження пам'яті, нестійкість при ходьбі, шум в голові, порушення сну. Значно більше виражені об’єктивні неврологічні розлади у вигляді досить чітких вестибуло-атаксичного, пірамідного, псевдобульбарного, підкіркового й іншого синдромів, а також інтелектуально-мнестичні порушення. У деяких хворих розвивається деменція.
Таким чином, крім неврологічних розладів, облігатними клінічними ознаками ДЕ є когнітивні порушення: зниження уваги, концентрації, порушення оперативної пам’яті, зниження розумової працездатності, та ін. Слід зауважити, що когнітивні порушення в поєднанні з неврологічними розладами становлять основу клінічної картини ДЕ (Supprian T., Kessler H., Retz W., 2003; Pagliery C. et al., 2004; Qiu C. et al., 2004).
2.2. Діагностика гіпертонічної дисциркуляторної енцефалопатії.
Діагностика ГДЕ, окрім клінічного обстеження, включає в себе цілу низку інструментальних методик. Особливий інтерес дослідників викликають неінвазивні методи дослідження церебральної гемодинаміки, які дали б можливість оцінити гемодинамічну значимість патогенетичних факторів порушення кровообігу, ступінь морфологічних змін, а також діапазон функціональних можливостей судинної системи головного мозку (Furukawa M etal., 2002; Kitagawa K etal., 2005). Із розвитком науки та техніки набувають актуальності відносно нові для нашої країни методи додаткового обстеження та вдосконалення старих: ультразвукова доплерографія судин голови (УЗДГ) (Ятужис Д., Куприс Р., 1995; Никитин Ю.М., Труханов А.И., 1998; Калашников В.И., 2000; Лущик У.Б. і співав., 2004), магнітно-резонансна томографія (МРТ), КТ, однофотонноемісійна комп’ютерна томографія (ОФЕКТ) (Colon AJ., 2000; Залесский В.Н., Дынник О.Б., 2005), електроенцефалографія (ЕЕГ) (Жирмунская Е.А., Рухманов А.А., 1991), зокрема, картована. Не втратила своєї чинності реоенцефалографія (РЕГ) (Зенков Л.Р., Ронкин М.А., 2004).
Метод РЕГ – це визначення тонусу і кровообігу в судинах ГМ на основі вимірювання електричного опору мозковою тканиною. Аналіз реоенцефалограм здійснюють як візуальний, так і кількісний.
При візуальному аналізі виділяють крайні положення хвилі: початок, вершину, кінець. Із якісних ознак оцінюють: конфігурацію анакроти, катакроти, вершини, крутизни нахилу кривої, появу плато або двогорбої кривої.
Кількісна характеристика дозволяє уточнити характер змін, що визначались візуально. Основними і найбільш інформативними є наступні показники:
1. Реографічний індекс (РегІ) - співвідношення величини амплітуди до величини стандартного калібровочного сигналу, який дозволяє визначити відносну величину пульсового кровонаповнення в ділянці судинного русла, що вивчається.
2. Дикротичний індекс (ДКІ) - співвідношення величини реографічної хвилі на рівні інцизури до максимальної амплітуди, відображає переважно тонус артеріол і залежить від стану периферичного судинного опору, виражається в відсотках.
3. Діастолічний індекс (ДСІ) - співвідношення величини амплітуди на рівні дикротичного зубця до максимальної амплітуди реографічної хвилі, відображає стан відтоку крові із артерій у вени, виражається у відсотках.
4. Коефіцієнт асиметрії (КА), вираховується по формулі:
КА= [(Аб - Ам)/Ам]´100%,
Де Аб – амплітуда реограми на боці, де РегІ більший;
Ам – амплітуда реограми на боці, де РегІ менший.
5. Час висхідної частини реографічної хвилі (a) - відображає період повного розкриття судин, вимірюється в секундах і дає інформацію про стан судинної стінки.
6. Модуль пружності (a/Т) - співвідношення тривалості анакроти до тривалості всієї пульсової хвилі, дає свідчення про судинний тонус, вимірюється в % і збільшується при підвищенні тонічного опору та навпаки.
Встановлено, що 80-90 % змін опору, обумовлено динамікою внутрішньочерепного кровообігу і лише 10-20 % - динамікою кровообігу шкірних покривів голови (Байбурин Ф. Я. и соавт., 1998). У хворих з АГ виявлений один надійний маркер по даних РЕГ – висока частота міжпівкулевої асиметрії тонусу артерій; цікаво, що у 62 % випадків патологічні ознаки в лівій півкулі були більш виражені, ніж в правій.
Крім цього, характерними змінами на РЕГ при ГДЕ будуть заокруглення вершини хвилі, зміщення дикротичного зубця до вершини, незначна його вираженість, зниження реографічного індексу, вповільнення підйому анакротичної фази, що свідчить про значне підвищення тонусу артеріол і вен мозку та супроводжується зменшенням мозкового кровонаповнення.
За даними РЕГ при гіпертонічній хворобі (ГХ) ранніх стадій в каротидному басейні відбуваються достовірні зміни судинного опору, у яких ДКІ та ДСІ збільшуються. Кровонаповнення в цьому басейні в межах норми, а в вертебро-базилярному (ВББ) - знижується. В цей же час значно зменшується тонус великих артерій (судимо по модулю пружності) і судин венозного русла в цьому басейні.
Що стосується доплерографії, то вона успішно використовується для діагностики ураження екстракраніальних артерій в варіанті УЗДГ, тоді як питання про застосування для виявлення патології мозкових судин – транскраніальної доплерографії потребує додаткового вивчення (Орос М.М., 2002).
При УЗДГ вивчення мозкового кровотоку проводять при якісному аналізі, а також кількісній оцінці результатів. Якісний аналіз спектрограм базується на візуальній оцінці форми доплерограми, її деформації, вираженості систолічної та діастолічної фаз кровотоку, розміщення хвилі відносно ізолінії.
За нашими даними (Ханенко Н.В., 2003) при візуалізації магістральних артерій голови 98 хворих з ГДЕ І-ІІ стадії виявлено деформації, перш за все сонних і хребцевих артерій (ХА): перегини, звивистість, петлі, які при підвищенні АТ можуть давати картину стенозів, викликаючи локальні порушення гемодинаміки з можливим розвитком дефіциту кровотоку в дистальному руслі. За нашими даними деформації магістральних судин голови найбільш часто виявлялись в ХА – 46,7 % від загальної кількості виявлених деформацій; над устям внутрішньої сонної артерії (ВСА) – 33,3 %; над устям загальної сонної артерії (ЗСА) – 20 %. Розподілення деформацій за частотою локалізації зображені на рис.1. Відмічені випадки стенозування магістральних артерій голови екстракраніального відділу каротидного басейну (не більше 23-40 % по діаметру судини) (ступені стенозу по Никитину Ю.М., Трухановой А.И., 1998) – у 73,4%. Так, за нашими даними частота стенозування лівої ВСА в два рази переважає над частотою стенозування правої ВСА ( відповідно,
40,8% та 20,4%). Що стосується ЗСА, то тут ми відмітили у 7 пацієнтів старших вікових груп (>65 років) стенозування тільки правої ЗСА, що ймовірно обумовлене анатомо-функціональним станом судин дуги аорти (права ЗСА відходить від плечеголовного стовбура дуги аорти) та наявністю супутнього атеросклеротичного процесу, характерного для старших вікових груп у хворих з АГ.
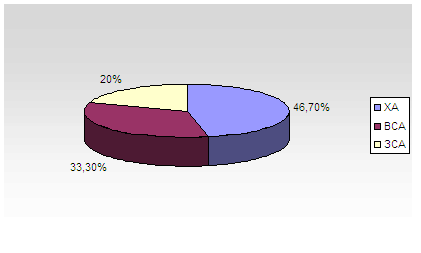
Рисунок 1. Частота деформацій магістральних артерій голови.(далі буде)
Для більш точного аналізу спектрограм та статистичної обробки результатів вираховують кількісні показники. Основними параметрами доплерографічного спектру є максимальна систолічна швидкість кровотоку (Vs), коефіцієнт асиметрії (КА), кінцева діастолічна швидкість (Vd) та середня швидкість кровотоку за цикл (Vm) - один із найбільш вагомих показників УЗДГ, так як вона меншою мірою залежить від частоти серцевих скорочень (ЧСС), скорочувальної функції серця, загального периферичного опору і корелює з церебральною перфузією. Відомо, що лінійна швидкість кровотоку відображає стан гемодинаміки в цілому, залежить від діаметру судини, реологічних властивостей крові, насосної функції міокарду, еластико-тонічних властивостей судинної стінки. Даний показник автоматично вираховується мікропроцесором за формулою:
Vs + (Vd × 2)
Vm = --------------------
3
Коефіцієнт асиметрії (КА) лінійної систолічної швидкості в однойменних артеріях вираховується за формулою:
Vs1 - Vs2
Vs2
де Vs1 > Vs2
Крім швидкісних показників вираховуються статистичні показники, що відображають зміни форми спектральної хвилі – індекс пульсації (РІ) та індекс периферичного опору (RІ). РІ відображає неперервність та опір потоку крові, становить в нормі 1,5-2,5 та вираховується за формулою:
Vs - Vd
Vm
Індекс периферичного опору вказує на судинний опір, стан прохідності артерії вище її місця локації. При низькому опорі судин підвищується діастолічна швидкість, що веде до зниження RІ, і навпаки. Даний показник вираховується за формулою:
Vps - Vd
RІ = -----------------
Vps
При ДЕ, що виникла на фоні АГ, спостерігається підвищення лінійної швидкості кровотоку (ЛШК) в ВСА, середній та задній мозкових артеріях (СМА та ЗМА), асиметрія ЛШК в інтрацеребральних артеріях (Кабанов А.А., 2000). Показники, що відображають зміни величини периферичного судинного опору, тобто пульсаційний індекс (PI) та судинного опору (RI) також збільшуються, що розцінюється як стан гіперперфузії (Ященко И.А., Елер Е.М., Савчук Е.А., 2002). Збільшення ЛШК по ВСА свідчить про підвищену реактивність судин, до вазоконстрикторних впливів і відображає порушення центральної регуляції тонусу судин, оскільки великі артерії першими реагують на зрив регуляторних механізмів, у той час як церебральні судини середнього і дрібного калібру більш автономні і включаються в патологічний процес набагато пізніше (Шахнович А. Р., Шахнович В. А., 1996; Токтомаметов А.У.,Шлейфер С.Г., 2003). Таким чином, високі цифри АТ приводять до виникнення гіперперфузії по основним артеріях (ОА) головного мозку, що в свою чергу сприяє виникненню вазоспазму різної тяжкості і, можливо, проліферацію гладком’язевого матриксу судинної стінки (Кабанов А.А., 2000). Назинян А.Г., Шмидт Т.Е. (2001) і Ященко И.А., Елер Е.М., Савчук Е.А. (2002) вважають, що якщо основною причиною виникнення ДЕ є АГ, то ЛШК зменшується спочатку в судинах каротидного басейну.
В результаті численних досліджень було встановлено, що наростання симптомів органічного ураження нервової системи в міру прогресування судинної патології головного мозку відповідає зниженню величини середньої ЛШК по всіх внутрішньочерепних артеріях, причому найбільш значимою ознакою стадії ДЕ є показники ЛШК у СМА, наростання неврологічної симптоматики обумовлено не тільки ступенем і локалізацією екстракраніальних уражень церебральних артерій, але й зниженням функціональних можливостей колатерального кровотоку (Міщенко Т. і співав., 2005).
Якщо в клінічній картині домінують симптоми порушення кровообігу з боку ВББ, то найбільш інформативним критерієм ДЕ, що виникла на фоні АГ є підвищення ЛШК по ХА на 20% й більше та збільшення PI й RI до 1,0-1,1 (Міхаль Г.В., Чеботарьова Л.Л., 2003). Також автори розрізняють 3 типи гемодинаміки у хворих з ДЕ:
1) гіперкінетичний – характеризується підвищеною ЛШК та індексів судинного опору, що свідчить про компенсаторну реакцію судин, спрямовану на підтримання достатнього кровотоку;
2) гіпердинамічний – збільшена ЛШК, але знижені індекси;
3) гіпокінетичний – знижена ЛШК та індекси судинного опору, що є найбільш характерним для ІІІ ст. ДЕ.
Отже, результати УЗДГ обстеження хворих ГДЕ за даними різних авторів мають відмінності. Можливо, причина такої розбіжності результатів в неоднорідності груп обстежених хворих, де немає чіткого розмежування за етіологічним фактором.
Сукупність УЗДГ та РЕГ обстеження у осіб, що страждають цереброваскулярною патологією дозволяє з більшим ступенем ймовірності оцінити характер розладів церебральної гемодинаміки, так як дві ці функціонально-діагностичні методики дозволяють отримати взаємодоповнюючу інформацію.
Останнім часом все частіше вивчається цереброваскулярна реактивність як інтегральний показник адаптаційних можливостей системи мозкового кровообігу, здатності судин мозку реагувати на змінені умови функціонування і дає можливість оптимізувати кровотік відповідно з цими умовами. Для хворих з ДЕ характерними є зміни цереброваскулярної реактивності, яка має чітку залежність від віку та стадії захворювання; деколи виникає така ситуація, коли у хворих з ДЕ ІІ і ІІІ стадії, особливо старшого віку, спостерігається практично ареактивність (Калашников В.И., 2000). За даними Кабанова А.А. (2000) переважно у третини хворих з відсутністю ознак ураження магістральних артерій виявляється зниження цереброваскулярного резерву або гіперконстрикторні реакції, що можна пояснити ураженням артерій більш дрібного калібру, локальними порушеннями метаболізму та мікроциркуляції. На нашу думку, вище сказане говорить про необхідність враховувати при виборі тактики лікування реактивність мозкових судин. При ДЕ, що виникає на фоні ГХ, характерне зниження цереброваскулярної реактивності з перевагою вазодилятаційних реакцій (Кабанов А.А., 2000), на відміну від атеросклеротичного ураження судин ГМ. При вивченні характеру мозкового кровообігу у хворих з гіпертензією виявилось зниження судинного опору церебральних судин у відповідь на фізичне навантаження, а також зниження показника здатності мозкової ауторегуляції, що свідчить про глибоку депресію механізму ауторегуляції мозкового кровотоку у хворих ессенціальною гіпертензією.
Виявлені порушення церебральної гемодинаміки дозволяють передбачити їх роль в формуванні гіпоксії кори ГМ і зміні функціонального стану центральної нервової системи (ЦНС). Найбільш адекватним способом його вивчення є ЕЕГ, зокрема спектральний аналіз. Призначення спектрального аналізу – допомога в отриманні об’єктивної оцінки спектральних показників та пришвидшення проведення амплітудно-частотного аналізу, більш наглядна ілюстрація його результатів.
Аналіз літературних даних щодо змін біоелектричної активності ГМ дає можливість порівняти інформативність ЕЕГ в контексті ранньої діагностики ДЕ. Автори пояснюють зміни біоелектричної активності мозку зі зниженням регіонального мозкового кровообігу, переважним ушкодженням тієї чи іншої частки ЦНС, що і зумовлює сповільнення ритмів ЕЕГ, пояснює різноманітність змін на ЕЕГ.
Методом картування ЕЕГ реєструються біопотенціали ГМ, пов’язані із функціональними порушеннями життєдіяльності коркових нейронів, що є недоступним для комп’ютерної томографії чи будь-яких інших методик, що є досить вагомим аргументом на користь даної діагностики.
Для клінічної характеристики ЕЕГ використовують частотно-амплітудні показники по Е.А.Жирмунській (1997).
І тип – нормальна ЕЕГ з перевагою α-хвиль з амплітудою в межах 25-55 мкВ, помірна кількість β-ритмів діапазоном 5-15 мкВ, повільні хвилі (θ і Δ) амплітудою 15-20 мкВ реєструється в 5-10 разів менше, ніж α-хвилі.
ІІ тип – гіперсинхронна ЕЕГ в різних варіантах із збільшенням кількості α-хвиль (55-110мкВ) порівняно із β і Δ.
ІІІ тип – десинхронна – зменшення кількості α-хвиль із зниженою амплітудою 10-20 мкВ; збільшення у 13-15 разів кількості β-хвиль, невелике збільшення кількості повільних хвиль.
ІV тип – нерегулярна, дезорганізована ЕЕГ: α-ритм невиразний, реєструються поодинокі α-хвилі, кількість β- зменшена, кількість повільних хвиль збільшена помірно. Амплітуда всіх частот 25-40 мкВ.
V тип – грубодезорганізований: переважно високоамплітудні повільні хвилі, спостерігаються повільні хвилі або пароксизмальні спалахи, комплекси гострих і повільних хвиль.
VІ – ЕЕГ з локальними порушеннями з наявністю вогнищевих або однопівкульових зміщень на ЕЕГ.
В здорової людини виділяють два основних види ритмічних коливань - a- і b-хвилі. Домінуючим є a-ритм, що реєструється в середньопотиличних відділах мозку з частотою 8-13/секунду і амплітудою до 100 мкВ. b-ритм реєструється в передніх відділах мозку з частотою 14-40 коливань за секунду і середньою амплітудою 20 мкВ. При візуальному методі оцінки ЕЕГ аналізують зміни нормальних компонентів (частоти, форми основних ритмів), зникнення окремих компонентів, наявність гіпер- або десинхронізації. Важливе діагностичне значення має поява патологічних форм коливань – повільних ритмів: q-ритму (з частотою 4-7 коливань в секунду), Δ-ритму (з частотою менше 4/секунду), а також гострих потенціалів – пік-хвиля, спайк-хвиля, комплексів “пік або пік-повільна хвиля”.
На І стадії захворювання ЕЕГ відображає нейродинамічні розлади, добре виражені зональні відмінності та реактивність, що відповідає І або ІІ типу ЕЕГ. В ІІ стадії ДЕ переважає ЕЕГ ІІІ типу та ІV. Для ІІІ стадії захворювання характерна картина ІVта Vтипи ЕЕГ. В багатьох хворих реєструється міжпівкульова асиметрія, патологічні фокуси і пароксизмальна активність, зональні відмінності не виражені, реактивність слабка або відсутня.
Слід відмітити, що зсуви ЕЕГ є максимальними при порушенні кровообігу в басейні СМА, а мінімальними – при ураженні в ВББ, зокрема ЗМА. Гіпоксія мозку на ЕЕГ супроводжується десинхронізацією, активацією α-ритму з наступним переходом до високоамплітудного θ- і Δ -ритму.
За результатами наших спостережень (Ханенко Н.В., 2003) для хворих з ГДЕ характерна в більшості випадків дифузна дизритмія біоелектричної активності ГМ з нерегулярними α- та β-ритмами, наявними низькими та високими частотами, вираженою низькоамплітудною повільною активністю та швидкими асинхронними коливаннями, що відповідає третьому типу ЕЕГ і зустрічається у 42% випадків. У частини хворих була відсутня α-активність, а β-активність - нерегулярна з чергуванням високих та низьких частот, з’явились швидкі асинхронні хвилі. У 36% хворих на ЕЕГ у всіх відведеннях на фоні чіткої регулярності ритмів домінують високоамплітудні повільні та гострі хвилі з наявністю одного домінуючого α-, θ- чи β–ритму в усіх ділянках головного мозку, така картина характерна для ІV типу ЕЕГ. За нашими даними у 11% спостерігається міжпівкульова асиметрія.
Характерним для хворих з ГДЕ І стадії є зміни біоелектричної активності ГМ дифузного характеру у вигляді дезорганізації α-ритму, які характеризуються появою незначної кількості асинхронних коливань на фоні низькоамплітудної активності, що, можливо, є свідченням зворотності нейрофункціонального ураження кори ГМ. В ІІ стадії ГДЕ, коли відбувається органічне незворотнє ураження структур головного мозку, переважала висока амплітудна активність та реєструвались θ-ритми поряд з патологічним Δ-ритмом.
Величина α-індексу залежить від ступеня вираженості АГ, а β-активність нижча, ніж в нормі. При пограничній АГ спостерігається розширений частотний діапазон при функціональних пробах. За даними ЕЕГ у хворих на ДЕ в поєднанні з гіпертензією крім дезорганізації α-хвиль, з’являється Δ-ритми з тенденцією до генералізації та прискорення (до 8-10 і швидше за 1секунду) у відповідь на подразнення. В залежності від стадії розвитку ДЕ відбувається уповільнення динаміки хвиль до 0,5-1 коливання за 1 секунду, зниження амплітуди α-активності.
Усі зазначенні особливості за нашими даними (Паламарчук І.С., 2007)чітко (р>0,05) проявляються при стимуляційних пробах (фоно-, фотостимуляції та гіпервентиляції), в ході яких у більшості хворих (68%) відмічаються порушення засвоєння ритму на частотах, котрі відповідають фізіологічно нормальним для здорових осіб ритмам.При пробі із відкриттям очей фіксується знижена реакція згасання α-ритму, що є ознакою гіпореактивності мозку (рис.2).
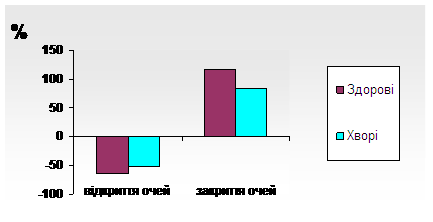
Рисунок 2. Особливості реакції α-ритму (індекси депресії та відновлення) ЕЕГ при відкриванні та закриванні очей у здорових та хворих з ГДЕ.
Примітка:вік обстежених від 40 до 59 років.
Цікаві дані виявляє топографічне дослідження основних ритмів мозку - домінантні відведення в потиличних областях (проекції вазомоторного центру) достовірно відрізняються від норми - якщо у більшості (80-90%) здорових осіб тут домінує α-активність (<14 Гц), то при ішемії мозку домінуючою є здебільшого (70-80%) біоелектрична активність на відносно вищих частотах (≥14 Гц, β-активність).
Однак, прямої кореляції у хворих з ГДЕ між патернами кровотоку в ВББ і патернами змін біоелектричної активностіГМ (по Є.І.Жирмунській) не виявлено. В цей же час спостерігається взаємозв’язок між змінами кровотоку в основній артерії (ОА) та реакцією біоелектричної активності ГМ на пробу з гіпервентиляцією. Тому виникає необхідність комплексного вивчення церебральної гемодинаміки з оцінкою реактивності мозкових артерій, а також співставлення змін гемодинаміки з біоелектричною активністю ГМ для уточнення складного патогенезу ДЕ.
Одними із сучасних методів дослідження є МРТ таКТ, які особливо актуальні для диференційної діагностики при осередковій органічній симптоматиці, що часто супроводжує ГДЕ, а також для уточнення характеру патологічного процесу (Зозуля И.С., Алексеева Т.С., 2004; Furukawa M. etal., 2002). До прямих КТ-ознак ДЕ відносять одиничні або множинні невеликі осередки зниженої щільності з чіткими чи розмитими контурами, які містяться в глибоких відділах півкуль мозку, а також об’ємні зони пониженої щільності, що переважно знаходяться в білій речовині перивентрикулярно (Верещагин Н.В., Моргунов В.А., Гулевская Г.С., 1997). Непрямими ознаками ГДЕ є розширення шлуночкової системи мозку або тільки деяких її відділів, а також розширення ряду борозен півкуль великого мозку (Лобзин С.В., Шангин А.Б., Роговенко А.В., 2000).
За результатами досліджень деяких авторів при ДЕ І стадії спостерігається зовнішня гідроцефалія. Осередкових змін речовини мозку не виявлено. При ДЕ ІІ стадії – розширення ліквороносних шляхів різного ступеню вираженості, у більшості випадків розширення центральних відділів, характерне збільшення площі бокових шлуночків і зменшення ширини конвекситальних борозд, розширення субарахноїдального простору (Жарков А.Н., Ратников В.А., Бутко Д.Ю., 2005). Осередкові зміни у вигляді одиночних осередків підвищеної щільності, як правило спостерігаються в базальних гангліях, підкірці.
Дослідження А.У. Токтомаметової і С.Г. Шлейфера (2003) показали, що МРТ-картина при ГДЕ, має свої структурні особливості: осередки демієлінізації і лейкоареоза обширні і множинні, вони розміщуються глибоко в білій речовині двох півкуль мозку. Навпаки, при атеросклеротичній енцефалопатії спостерігають атрофію мозку й осередки ураження білої речовини ближче до kори, частіше в правій мозковій півкулі
. 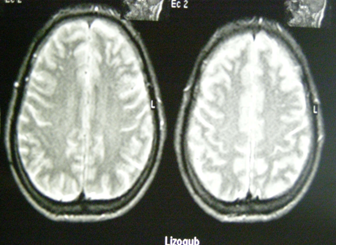
Рисунок 3. МРТ хворого з ГДЕ ІІ ст. (осередки лейкоареозу в лобних
долях, розширення конвекситальних просторів).
Останнім часом в об’єктивізації змін при цереброваскулярній патології значна роль надається методам молекулярної візуалізації, що набувають значимості в діагностиці, це зокрема ОФЕКТ, яка дає і кількісну характеристику змін при ГДЕ (Касаткин Ю.Н., 2004; Залесский В.Н., Дынник О.Б., 2005). Застосовуються ізотопи з коротким періодом розпаду, які входять всклад природних метаболітів мозку. Завдяки цьому стало можливе одномоментне вивчення метаболізму, кровотоку і структури мозку.
Слід відмітити, що стенотичні та субстенотичні ураження магістральних артерій голови рідко виникають без осередкової ішемічної патології на КТ чи МРТ (Залесский В.Н., Дынник О.Б., 2005), однак за даними Юршевич Е.А., Евстигнеева В.В. (2002), у жодному випадку не було виявлено осередків підкіркової локалізації. Розвиток ішемії в ВББ визначався не тільки при судинній патології в цьому басейні (висока ЛШК), але і при асиметрії кровотоку по СМА. Феномен лейкоареозу частіше за все зустрічався при наявності низької швидкості в ВББ та при порушеному співвідношенні швидкості у вигляді ПМА>СМА.
На сьогоднішній день в неврології все частіше застосовуються такі методики діагностики як варіабельність ритму серця (ВРС) та Холтерівський моніторинг (ХМ) АТ, які мають досить широке використання в кардіологічній практиці. З їх допомогою розширюються можливості лікаря як в діагностичному плані, так і в лікувальному, і в скорому майбутньому вони стануть стандартними методиками (Pagani M, Lucini D., 2001; Pagani M., Lucini D., 2002). Розробка методів комп’ютерного моніторування параметрів гемодинаміки дала можливість об’єктивізувати кількісну оцінку варіабельності АТ. Величини АТ, які отримують при разових вимірюваннях і при моніторингу, розрізняються. Традиційні вимірювання проводять в „стандартних” умовах, що виключають пресорний вплив фізичного і психо-емоційного навантаження. Ймовірно, що на середній рівень АТ впливають як рівень навантажень в період моніторингу, так і особливості пресорних реакцій. Таким чином, середній рівень АТ величина перемінна, тому доцільно використовувати дані моніторингу (Козлова И.Б., Кудина Е.А., Прокофьева Е.Н., 2000).
Показання до проведення добового моніторування АТтакі:
1. Різкі коливання АТ під час одного або декількох візитів;
2. Підозра на „гіпертонію білого халата” у хворих з низьким ризиком серцево-судинних захворювань;
3. Підозра на епізоди гіпотонії;
4. АГ, рефрактерна до медикаментозного лікування.
Велике значення для досягнення вірних результатів при мінімальній кількості помилкових вимірів має правильне поводження пацієнта під час моніторування:
Із вирахуваних значень виводять середні денні та нічні показники систолічного артеріального тиску (САТ), діастолічного артеріального тиску (ДАТ), середній АТ, мінімальні та максимальні цифри. За нормативні значення приймались слідуючи показники: 140/90 мм. рт. ст. в денний період, в нічний – 120/80 мм. рт. ст.
Оцінюють добовий ритм по величині нічного зниження САТ і ДАТ, який вираховується в процентному відношенні різниці між рівнем АТ вдень і вночі до його рівня вдень. Формула для його визначення така:
середній САТ(д)-середній САТ(н)
-------------------------------------------- × 100%,
середній САТ(д)
де САТ(д) – систолічний АТ вдень, САТ(н) - систолічний АТ вночі.
середній ДАТ(д)-середній ДАТ(н)
-------------------------------------------- × 100%,
середній ДАТ(д)
де ДАТ(д) – діастолічний АТ вдень, ДАТ(н) - діастолічний АТ вночі.
Інформативними в плані прогнозу АГ є показники варіабельності АТ, а також добовий індекс та індекс навантаження тиском(Козлова И.Б., Кудина Е.А., Прокофьева Е.Н., 2000; Лышова О.В., Провоторов В.М., 2000).
За нашими дослідженнями у хворих з ГДЕ І-ІІ стадії було виявлено таке розподілення по добовому профілю АТ з урахуванням добового індексу: night piker – 5,8%; over-dipper – 6,4% (добовий індекс > 20%); dipper –75,6% (добовий індекс 10-20%); non-dipper – 7,1% (добовий індекс < 10%); у 5,1% обстеження не було проведене до кінця із-за непереносимості процедури. Дані наведені в табл. 3.
Таблиця 3.
Розподіл АТ по добовому профілю у здорових і хворих з ГДЕ
|
Добовий індекс |
Здорові |
Хворі з ГДЕ І-ІІ ст. |
|
10-20% dipper |
93,3% |
75,6% |
|
< 10% non-dipper |
6,6% |
7,1% |
|
> 20% over-dipper |
- |
6,4% |
|
night piker |
- |
5,8% |
Ризик раптової смерті від інсульту в ранкові часи (700-900) найвищий, однак абсолютні величини АТ в ранкові часи не завжди співпадають з максимальними даними, однак важливим є те, що швидкість зміни АТ зранку є максимальною (Мечетний Ю.М., 2003).
Отримані середні показники дають основне уявлення про рівень АТ в конкретного хворого і мають високу прогностичну значимість. Між величиною клінічного і середнього АТ існує достовірний кореляційний взаємозв’язок. Зміна середніх показників в процесі лікування – найважливіша характеристика ефективності лікування (Бакшеев В.И. и соавт., 2000; Берг А.Г., 2000; Бойцов С.А., 2000).
Спектральний аналіз спонтанних коливань АТ виявляє наявність декількох типів потужності, головні з яких відображають активність симпатичної і парасимпатичної нервової системи. Варіабельність АТ відображає ефективність функціонування механізмів його стабілізації, однак, ні один із механізмів не є універсальним засобом його регуляції (Козлова И.Б., Кудина Е.А., Прокофьева Е.Н., 2000).
Так, в результаті аналізу даних обстежень, проведених у хворих з ГХ, було виявлено достовірне зниження активності парасимпатичної системи і тенденція до збільшення активності симпатичного відділу нервової системи. В цей же час при аналізі показників ВРС у хворих з ГХ виявилось, що добова динаміка АТ не може бути пояснена змінами тільки вегетативного статусу (Бойцов С.А., 2000), а залежить від особливостей функціонування інших систем регуляції АТ. Та виражені взаємозв’язки між параметрами АТ та ВРС у хворих з ГХ вказують на значну роль вегетативної нервової системи в ґенезі цього захворювання. Дослідження проведені в клініці у хворих з ГХ показують, що відношення амплітуд низькочастотного діапазону коливань і високочастотного під час сну було низьким, що свідчило про зниження активності симпатичної нервової системи. В цей же час спостерігалась відсутність нічного падіння АТ (Козлова И.Б., Кудина Е.А., Прокофьева Е.Н., 2000). Можна сказати, що активність вегетативної нервової системи не пов’язана напряму із підвищеним рівнем АТ. Більше значення для розвитку судинної патології ГМ має порушення добового ритму коливань його активності (Машин В.В., Белова Л.А., Кадыков А.С., 2003; Лущик У.Б., 2004).
У хворих на ГХ з різноманітними моделями АГ варіабельність АТ вища, ніж в нормі, однак її взаємодія з рівнем АТ не складається в просту схему причинно-наслідкових зв’язків. Незважаючи на основну роль барорефлекторного рефлексу в згладжуванні коливань АТ, його роль в регуляції спонтанної варіабельності АТ є неоднозначною. Дослідження не підтверджують існування кореляції між варіабельністю АТ та величиною барорефлексу.
Проведені нами дослідження підтвердили вище сказані дані. Із збільшенням тяжкості перебігу ДЕ збільшується коливання АТ протягом доби, а висока варіабельність в АТ в денний період свідчить про зниження адаптаційних можливостей (Волошина О.Б., Шмакова І.П., Михальченко І.В., 2005).У більшості хворих зберігається двохфазність ритму АТ, що свідчить про правильність добового профілю. Однак, рівень нічного АТ навіть при максимальному зниженні у хворого гіпертензією еквівалентний або вищий, ніж у нормотензивних людей (Берг А.Г., 2000;Машин В.В., Белова Л.А., Кадыков А.С., 2003).
Отже, в багаточисленних дослідженнях показано прогностичне значення різноманітних параметрів ХМ АТ. Встановлена залежність розвитку ураження органів-мішеней АГ і серцево-судинних ускладнень не тільки від рівня АТ, але і з порушенням добового ритму АТ, підвищеною варіабельністю, наявністю і величиною ранкових піків АТ (Гераскина Л.А, Фонякин А.В., Суслина З.А., 2004).
Тому проведення добового моніторування АТ є ефективним методом, що допомагає в оцінці та контролі АТ і в аргументації вибору гіпотензивних препаратів. Підбір адекватної гіпотензивної терапії є досить складним і, в той же час, важливим завданням для лікаря-клініциста, так як дозволяє ефективно контролювати рівень АТ, добитися зниження частоти виникнення таких ускладнень ГХ, як інсульт та інфаркт серця, і значно покращити якість життя пацієнтів. В цьому плані, індивідуалізація фармакотерапії на основі вивчення хронобіологічних змін добових ритмів АТ є оправданим і метод добового моніторування при цьому грає одну із основних ролей (Бакшеев В.И. и соавт., 2000). Таким чином, при підборі гіпотензивної терапії необхідно враховувати добовий ритм АТ. Лікування повинне бути спрямоване на зниження підвищеної варіабельності і не впливати на нормальну, забезпечувати адекватний контроль АТ в ранкові часи.
При вивченні даних ХМ АТ та основних синдромів за древньосхідною теорією – “ЯН” та “ІНЬ”, також їхнього співставлення у хворих з гіпертензією виявилось, що механізм патогенезу гіпертензії полягає в дисгармонії “ІНЬ”-“ЯН” (Xia Yisi, Chen Keyi, Miao Yong, 1998), що веде до необмеженої гіперреактивності “ЯН”-синдрому.
Функціональний стан серцево-судинної системи (ССС) значно впливає на церебральний кровообіг, так як ГМ використовує близько 20% серцевого викиду (Арабидзе Г.Г., Арабидзе Гр. Г., 1999). А регуляція серцевої діяльності забезпечується вегетативною нервовою системою. В свою чергу ВРС є маркером вегетативної активності, діагностичного і прогностичного факторів при різноманітних захворюваннях (Pagani M, Lucini D., 2001; Kolasinska-Kloch W. etal., 2002; Попов В.В. Фрицше Л.Н., 2006). Варіабельність серцевого ритму позначається, як HRV (heartratevariability). Встановлено, що його аналіз є важливим методом оцінки функції автономної вегетативної системи серця. При вивченні ВРС використовується частотний аналіз. Розрізняють дихальну аритмію – скорочення інтервалу RR під час вдиху і збільшення під час видиху. Цей цикл виникає з частотою 0,20 Гц. Також є аритмія, пов’язана з періодичністю зміни АТ, який регулюється барорецепторами (0,10 Гц). Нерегулярність синусового ритму може бути пов’язана з вегетативною регуляцією температури тіла, дехто зв’язує її з діяльністю ренін-ангіотензин-альдостероновою системою. Ця аритмія характеризується найбільш тривалим циклом мінливості інтервалу RR, з частотою 0,05 Гц. Описані цикли варіабельності інтервалів накладаються один на одного в певній періодичності і додатково їх ритмічність залежить від природної активності людини (Попов В.В. Фрицше Л.Н., 2006).
Частотний аналіз дає інформацію про динамічну рівновагу вегетативної нервової системи, дає можливість оцінити ступінь ураження симпатичної та парасимпатичної ланок нервової системи. Основним методом аналізу ВРС є спектральний аналіз кардіоритмограми. Спектр ритмограми – це залежність амплітуди коливань серцевого ритму від частоти коливань.
Для аналізу хвильової структури ВРС використовують метод розрахунку спектра потужності, що базується на перетворенні ряду Фур’є і дозволяє визначити частоту та ступінь вираженості коливальних компонентів серцевого ритму. Для оцінки стану вегетативної регуляції обчислюють наступні показники:
Діапазони LF і VLF залежать від симпатичної нервової системи, а HF від парасимпатичної системи (Бойцов С.А. и соавт., Попов В.В. Фрицше Л.Н., 2006). Інші автори виділення трьох частотних діапазонів дещо уточнюють, тобто розходження обумовлене місцем їхнього формування: діапазон наднизьких частот - надсегментарними структурами; діапазон низьких частот - симпатичною нервовою системою; діапазон високих частот - парасимпатичною нервовою системою.
Більшість дослідників вважають, що виникнення дихальних хвиль пов’язане з дихальними змінами активності парасимпатичних серцевих нервів (Козлова И.Б. и соавт., 2000; Бобров В. и соавт., 2004). Ці ж дослідники стверджують, що середньочастотна компонента ВРС зумовлена функціонуванням барорефлекторного механізму, а зв’язок повільнохвильових коливань ВРС з активністю симпатичної системи найбільш ймовірний.
Враховуючи літературні дані, зміни парасимпатичних впливів на серцево-судинну систему (ССС) оцінюють за кількісними значеннями потужності HF. При значеннях потужності в процентному співвідношенні HF більше 50 % від сумарної потужності спектру констатують домінування парасимпатичних впливів на ССС.
Про стан барорефлекторної регуляції ССС роблять висновок за показником середньочастотної компоненти ВРС. Коливання активності симпатичного відділу вегетативної нервової системи, тонусу вазомоторів, активності ренін-ангіотензинової системи оцінюють за кількісним значенням потужності низькочастотної компоненти ВРС (VLF).
Для визначення типів вегетативної регуляції використовують діагностичні критерії складені за даними літератури (табл. 4).
Таблиця 4.
Діагностичні критерії варіантів вегетативної регуляції серцевого ритму
|
Варіант вегетативної регуляції |
Критерії |
Рівень показника |
|
Симпатикотонічний |
%VLF |
> 70 |
|
Парасимпатикокотонічний |
%HF |
> 750 |
|
Нормотонічний |
%HF |
30-50 |
При спектральному аналізі ВРС у хворих з ГДЕ за нашими даними спостерігалось збільшення низькочастотного компоненту – 704,3±129,8 мс2, а також підвищення симпатовагального індексу (LF/HF – 2,18±0,56 ум. од.), що свідчить про перевагу функції симпатичної нервової системи. Хоча, вказані зміни не є достовірними в порівнянні із практично здоровими людьми.
Вегетативний тонус у спокої у хворих з ГДЕ із переважанням симпатичної нервової системи був виявлений у 79,5%, в 10,9% - парасимпатикотонія, в 9,6% - відносний баланс симпатичної та парасимпатичної нервової системи (Ханенко Н.В., 2003). У той же час у практично здорових осіб переважає ейтонія (нормотонічний тип) – 66,7% (рис. 6). Однак, слід зауважити, що у хворих з переважанням парасимпатичної іннервації серцево-судинної системи, або при балансі вегетативної регуляції, спостерігаються досить високі цифри АТ. Це підтверджує той факт, що рівень системного тиску залежить не тільки від вегетативної регуляції, а від стану ендокринних функцій, зокрема функції гіпоталамо-гіпофізарно-наднирникової системи.
Цікаво, що із збільшенням давності ГХ несприятливі, щодо прогнозу захворювання зміни ВРС прогресують і стають максимальними при тривалості хвороби понад 5 років (Корсунська М.М. і співав., 2001).
Останнім часом при аналізі ВРС почали звертати увагу на адаптаційні можливості організму. Адаптаційні можливості організму - це запас функціональних резервів, які постійно витрачаються на підтримку рівноваги між організмом і навколишнім середовищем. Чим вище функціональні резерви, тим нижче ступінь напруги цих механізмів, необхідна для адаптації.
Отже, дослідження ВРС у хворих з ГДЕ дозволяє не лише оцінити ризик розвитку гострих судинних епізодів та адекватність терапії в разі констатованої ішемії мозку, але й виявити патологічні рефлекторні реакції ще на початкових етапах порушення мозкового кровопостачання, а тому повинне бути рутинним методом обстеження хворих неврологічного профілю. При цьомуособливості вегетативного дисбалансу проявляються повною мірою лише при функціональних пробах, тому вони є обов’язковими при ВРС-дослідженні. Із функціональних проб популярною є ортопроба – простий та ефективний спосіб, що дозволяє встановити ознаки зриву адаптації при цереброваскулярних захворюваннях (стан виснаження регуляторних систем) - зниження барорефлекторної чутливості, порушення регуляції ритму серця автономним контуром (Коркушко О.В. і співав., 2002).
Останні дослідження, проведені в цьому напрямку, показали, що у здорових обстежуваних у стані відносного спокою домінує надсегментарний рівень регуляції, тонус вегетативної регуляції зміщений убік симпатоадреналових процесів. На функціональні проби зростає активність переважно сегментарного рівня регуляції із збільшенням ролі симпатоадреналової системи. Отже, при переході у вертикальне положення зазвичай в нормі найбільшою мірою зменшується потужність (абсолютне значення) високочастотного спектру HF (зі сторони парасимпатичної нервової системи) і в меншій – потужність низькочастотних хвиль LF (зі сторони симпатичної нервової системи), що в кінцевому рахунку обумовлює певні зсуви в структурі спектру ВРС відносно фонового стану: спад HF%, VLF% та приріст LF% (Коркушко О.В. і співав., 2002). У пацієнтів ДЕ I стадії домінує активність надсегментарних структур, активність сегментарних - симпатичної й парасимпатичної нервової системи - перебуває в стані близькому до рівноваги. Реагування на навантаження відбувається зниженням активності надсегментарних структур із зсувом тонусу вегетативної регуляції убік симпатоадреналових процесів. У пацієнтів ДЕ II стадії вихідний стан характеризується підвищеним впливом надсегментарних структур і поєднаний з відсутністю реагування на навантаження, тонус вегетативної регуляції зміщений убік симпатоадреналовых процесів.
За нашими даними, у хворих з ГДЕ спад абсолютних величин усіх складових спектру, особливо низькочастотного спектру, зазвичай не достатній (рис.4) (Паламарчук І.С., 2007).
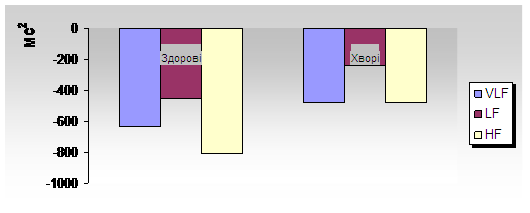
Рисунок 4.Динаміка частотних показників (різниця абсолютних значень) ВРС при активній ортопробі (5 хв.) у хворих з ГДЕ та здорових.
Примітка:вік обстежених від 40 до 59 років.
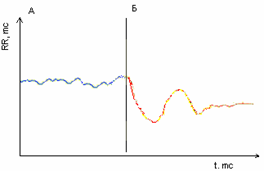
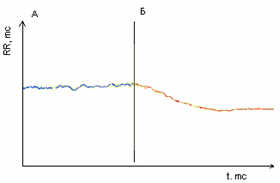
А при активній ортостатичній пробі перехідний процес серцевого ритму виявляє відмінний стан якісної характеристики - якщо в нормі у людей молодого та середнього віку перехідний процес має форму згасаючої синусоїди і зазвичай (у 95% випадків) містить три фази, тобто є триперіодичним типом (рис.5), то при ГДЕ часто присутній біперіодичний тип (рис. 6), при якому третя фаза відсутня.
|
Рисунок 5.Триперіодичний тип перехідного процесу активної ортостатичної проби у здорових осіб. Примітка:А – фоновий запис у лежачому положенні, Б – запис після активного переходу у стояче положення.
|
|
Рисунок 6.Біперіодичний тип перехідного процесу активної ортостатичної проби у хворих з ГДЕ. Примітка:А – фоновий запис у лежачому положенні, Б – запис після активного переходу у стояче положення.
|
Окрім якісних порушень перехідного стану ВРС при ортостатичному навантаженні у хворих з ГДЕ нами також були виявлені гемодинамічні розлади, а саме має місце гіподинамічний тип реакції АТ на ортостаз, при якому зсув САТ та ДАТ менший за 5 мм. рт. ст. При цьому більша редукція (р>0,05) спостерігається САТ на 5-й хвилині ортостазу, ніж ДАТ, що є проявом неадекватної компенсаторної реакції з боку серця у відповідь на зниження серцевого викиду, тобто має місце зниження ортостатичної стійкості гемодинаміки (табл. 5, рис.7).
Таблиця 5.
Зміни центральної гемодинаміки під час активної ортопроби хворих з ГДЕ
(запис 5 -10 хвилини) у, %
|
Зсуви показників, % |
Здорові особи |
Хворі |
|
ЧСС |
26±1,4 |
42±3,4 |
|
САТ |
-3,5±1,6 |
-30±3,4 |
|
ДАТ |
5±0,7 |
-0,5±0,6 |
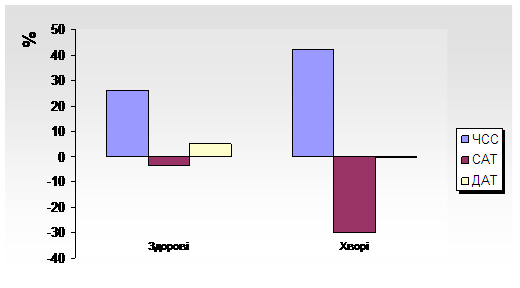
Рисунок 7.Підвищення варіабельності АТ у хворих з ГДЕ – гіподинамічний тип реакції на ортостаз
Примітка:вік обстежених від 40 до 59 років.
Частотний аналіз ритму серця даних пацієнтів виявив зниження ВРС, виснаженість парасимпатичної нервової системи, редукцію кардіальної барорецепторної чутливості на фоні функціонального навантаження (ортостатичної дії), що проявлялося у вигляді недостатнього приросту (різниця значень у горизонтальному та вертикальному положенні) вегетативного балансу LF/HF - відношення активності симпатичної нервової системи (LF спектр) до парасимпатичної (HF спектр). Так, якщо приріст вегетативного балансу LF/HF у групі здорових осіб становить 165%, то у хворих з гіпертонічною ГДЕ - 122% (рис.4).
Звичайно, в основі клінічного симптомокомплексу ДЕ лежить також прогресування когнітивних порушень, розпізнавання яких на ранніх етапах (коли найбільш ефективні профілактичні заходи) викликає певні труднощі. Тому нейропсихологічне обстеження хворих з ДЕ є досить важливим, воно допомагає в постановці точного діагнозу.
Уже на ранніх стадіях ДЕ спостерігається зниження психічної активності, швидка втомлюваність, зниження уваги.
Увага відноситься до загальних психічних проявів, тому увагу розглядають як процес, як стан і як якість особистості. До основних характеристик уваги відносять: об’єм, вибірковість, стійкість, концентрація, розподіл і переключення. Ці характеристики уваги являють собою функціональну єдність і тільки при проведенні психологічних проб можливе їхнє розділення.
Для визначення різних властивостей і характеристик уваги використовують різноманітні бланкові методи. Доступними для лікаря-невролога є такі психологічні проби, як:
Важливим для практики і найбільш залежним від стану ЦНС є переключення уваги. Від обстежуваного необхідне сумісне виконання двох та більше завдань. Потім проводиться співставлення часових характеристик. Обстеження проводиться за допомогою таблиць Шульте в різноманітних модифікаціях.
Як і увага, пам’ять також відноситься до загальних психічних явищ, так як включена у всі види діяльності людини. В залежності від виду психічної діяльності, по характеру мети діяльності, по часу зберігання інформації виділяють різні види і форми пам’яті. Нейропсихологічне дослідження дозволяє оцінити стан різних процесів пам’яті (запам’ятовування, відтворення, забування) і їх основних механізмів. Стан пам’яті можна вивчити за допомогою проби на запам’ятовування 10 слів (при п’ятиразовому повторюванні).
У хворих з ДЕ виконання завдань супроводжується помилками, виправлення яких часто потребує підказки. Хворі важко переключаються на нове завдання. Розлади вищих психічних функцій на більш пізніх стадіях захворювання проявляються гностичними, оптико-просторовими і мнестичними порушеннями в різному поєднанні.
Останнім часом для оцінки когнітивних функцій розширили діапазон шкал, тестів та опитувачів(Белова А.Н., 2004).Для оцінки пам’яті та уваги використовують Короткий тест „ Орієнтація – Пам’ять – Увага” (табл. 6), який був розроблений на основі більш довгої шкали по R.Katzman і співав., 1983р.. Система підрахунку сумарного балу по даній шкалі складна, враховується не число правильних відповідей, а число зроблених помилок по кожному з пунктів. При цьому для пунктів 1, 2, 3 передбачена можливість максимум однієї помилки, для пунктів 4, 5 – дві помилки ( якщо помилок і більше, ніж 2, все рівно в балах це буде відповідати 2 помилкам), для пункту 6 – максимум 5 помилок. Число зроблених по кожному пункту помилок множать на відповідний цьому пункту коефіцієнт („вага” помилки), і тільки потім отримані числа сумують. Максимальне число помилок в балах складає 28, чим менший бал, тим більше збережені когнітивні функції.
Таблиця 6.
Короткий тест „ Орієнтація – Пам’ять – Увага”
(по R.Katzman і співав., 1983р.)
|
№ |
Питання |
Максимальне число помилок |
Бал × „вага” помилки |
Кінцевий бал |
|
1. |
Який зараз рік? |
1 |
___ × 4 |
= __
|
|
2. |
Який зараз місяць? |
1 |
___ × 3 |
= __
|
|
3. |
Скільки зараз приблизно годин? (в межах однієї години) |
1 |
___ × 3 |
= __ |
|
4. |
Порахуйте в зворотному порядку, від 20 до 1 |
2 |
___ × 2 |
= __ |
|
5. |
Назвіть місяці року в зворотному порядку |
2 |
___ × 2 |
= __ |
|
6. |
Повторіть фразу, яку ви тільки що чули |
5 |
___ × 2 |
= __ |
|
|
Сумарна помилка виражається в балах = __ / 28
|
|||
Тест Повторення цифр (табл. 7) призначений для оцінки рівня уваги, завдяки простоті, однак не існує клінічної інтерпретації відхилення від нормальних результатів. Необхідно повторити названі рядки цифр в прямому та зворотному порядку. Бал по кожному з цих завдань дорівнює числу правильно повторених цифр, максимальний бал буде відповідати правильному повторенню всього рядка цифр.
Таблиця 7.
Тест Повторення цифр
(по D.Wechsler, 1945; D.Wade, 2000)
|
Повторення цифр в прямому порядку |
Максимальний бал |
Повторення цифр в зворотному порядку |
Максимальний бал |
|
6-4-3-9 |
4 |
2-8-3 |
3 |
|
7-2-8-6 |
4 |
4-1-5 |
3 |
|
4-2-7-3-1 |
5 |
3-2-7-9 |
4 |
|
7-5-8-3-6 |
5 |
4-9-6-8 |
4 |
|
6-1-9-4-7-3 |
6 |
1-2-5-8-7 |
5 |
|
3-9-2-4-8-7 |
6 |
6-1-8-4-3 |
5 |
|
5-9-1-7-4-2-3 |
7 |
5-3-9-4-1-8 |
6 |
|
4-1-7-9-3-8-6 |
7 |
7-2-4-8-5-6 |
6 |
|
5-8-1-9-2-6-4-7 |
8 |
8-1-2-9-3-6-5 |
7 |
|
3-8-2-9-5-1-7-4 |
8 |
4-7-3-6-9-2-8 |
7 |
|
Сумарний прямий бал ___________
|
Сумарний зворотний бал __________ |
||
До найбільш розповсюджених тестів на сьогоднішній день для визначення когнітивних функцій відносять Тест Міні-Ментал (Folestein M і співав., 1975р.). Тест включає оцінку пам’яті, уваги, орієнтації (табл. 8). Методологія тесту передбачає підрахунок балів по всій шкалі, при чому бал, який дорівнює 24, розглядається як пограничний для норми та патології. Рекомендується оцінювати і аналізувати відповідь на кожне питання, так як категорії, що відображені в шкалі є досить різноманітними. Доведена висока надійність тесту, тоді як чутливість в достатній мірі не вивчена.
Тест Міні-Менталвиявляє тільки достатньо виражені розлади і не чутливий до незначних порушень вищих коркових функцій, а також при амнезії, осередкових ураженнях правої півкулі. В балах оцінюються основні показники когнітивних функцій. Кожна правильна відповідь оцінюється в один бал (за косою лінією вказується максимальна кількість балів для даного завдання), потім підраховується сумарний бал (може складати від 0 до 30). Більш високий сумарний бал свідчить про більш високе збереження когнітивних функцій.
Таблиця 8.
Тест Міні-Ментал
(по Folestein M. і співавт., 1975)
|
Показники
|
Оцінка в балах |
|
Орієнтація: Назвати дату (рік, місяць, число, день тижня, годину) Назвати місцезнаходження (країна, місто, вулиця, лікарня, відділення)
Сприйняття: Дослідник називає три слова (наприклад, яблуко, стіл, олівець). Хворого просять повторити ці три слова, кожна правильна відповідь оцінюється в один бал. Потім хворого просять запам’ятати ці три слова.
Увага і рахунок: Відняти від 100 число 7, далі від залишку знову відняти 7, і так п’ять раз (100-7, 93-7, 86-7, 79-7, 72-7) (альтернативне завдання: сказати слово з п’яти букв, наприклад ПЕНАЛ, а далі по буквам навпаки - ЛАНЕП)
Пам’ять: Згадати три слова, які заучувались при виконанні другого завдання
Мова, читання, письмо: Назвати два предмети (наприклад, годинник та олівець) Повторити „ніяких але, чи ні” Трьохетапна команда (наприклад, команда „підніміть вказівний палець правої руки, доторкніться ним до носу, потім до лівого вуха”). За кожний правильно виконаний етап команди виставляється один бал. Прочитати і виконати написане на листку завдання наступного змісту: „Закрийте очі”. Написати речення. Один бал ставиться, якщо речення має підмет і присудок і є змістовним. Змалювати малюнок (два перехрещених п’ятикутники)
|
__________/ 5 __________/ 5
__________/ 3
__________/ 5
__________/ 3
__________/ 2 __________/ 1
__________/ 3
__________/ 1
__________/ 1 __________/ 1 |
Для хворих з ДЕ характерні емоційно-вольові розлади, які нерідко істотно затрудняють лікування, можливості соціальної адаптації хворих.Оцінка цих порушень важлива як для їхнього раннього виявлення і правильного вибору методів терапії, так і для визначення ефективності лікування хворого. Здебільшого переважають тривожно-депресивні розлади.
Розрізняють кілька типів тривоги - сигнальна, фобічна, соматизована, нормальна і т.д. Тривога - це психологічна або психопатологічна реакція на потенційну (очікувану або прогнозовану) небезпеку (тоді як страх — це реакція на реально присутню небезпеку) (Бевз И.А., 1999). Шкали для оцінки тривоги дозволяють отримувати лише орієнтовану, попередню інформацію, не вирішуючи задачі точної діагностики.
Шкала Кові (Covi Anxiety Scale) призначена для грубої оцінки тривоги (табл. 9).
Таблиця 9.
Шкала Кові для Оцінки Тривоги
Covi Anxiety Scale
(по L.Covi і співавт., 1979; И.А.Бевз, 1999)
|
|
Ознака
|
Варіанти відповідей
|
|
|
1. СКАРГИ
|
Відчуття нервозності, тремтіння, підвищеної лякливості, несподіваного безпричинного страху; побоювання, напруга або напруженість; необхідність уникнення певних місць і видів діяльності через виникнення страху; труднощі зосередження на завданні, яке виконується |
Відсутнє
|
0
|
|
Слабко
|
1
|
||
|
Помірно
|
2
|
||
|
Значно
|
3
|
||
|
Досить сильно |
4 |
||
|
2.ПОВЕДІНКА
|
Виглядає зляканим, тремтить, неспокійний, полохливий, напружений
|
Відсутнє
|
0
|
|
Слабко
|
1
|
||
|
Помірно
|
2
|
||
|
Значно
|
3
|
||
|
Досить сильно
|
4 |
||
|
3. СОМАТИЧНІ СИМПТОМИ ТРИВОГИ
|
Підвищене потовиділення, тремор; посилене або прискорене серцебиття; утруднений вдих; відчуття припливів жару або холоду; неспокійний сон; більш часте відвідування ванної кімнати; дискомфорт у епігастральній області; „ком” у горлі
|
Відсутнє
|
0
|
|
Слабко
|
1
|
||
|
Помірно
|
2
|
||
|
Значно
|
3
|
||
|
Досить сильно
|
4
|
||
Симптоми, які відображені в опитувачі, характеризують різні форми прояву тривожних розладів - скарги, поведінка, соматичні симптоми. Час оцінки визначається як „зараз” або „протягом останнього тижня”. Шкала заповнюється лікарем під час огляду та опитування хворого. Кожний із трьох пунктів шкали оцінюється по 5-бальній системі (від 0 до 4 балів), загальний бал дорівнює сумі всіх балів і може мати значення від 0 до 12. Сумарний бал від 0 до 2 за звичай розцінюється як відсутність тривожного стану, 2-5 балів - як наявність симптомів тривоги, 6 балів і вище - як тривожний стан. Витрати часу на заповнення шкали і підрахунок балів - не більш 20 хвилин. Доведено задовільну чутливість шкали при оцінці динаміки стану хворих із тривожними розладами.
Поряд із традиційними для сучасної медицини методиками діагностики цереброваскулярної патології використовуються нетрадиційні методи, зокрема метод Накатані, який є найбільш достовірним для оцінки стану енергетичного балансу організму (Бойцов И.В., 1998). Метод оснований на вимірюванні електрошкірного опору в репрезентативних точках, що дозволяє виявити дисбаланс в 12 класичних меридіанах. Ці точки, зразу ж при появі будь-яких зрушень в системах організму і органах, за рахунок так названих меридіанних зв’язків, починають реагувати на зміни, причому, ще на стадії функціональних порушень. Ця реакція в акупунктурних точках проявляється у вигляді зміни їх магнітного поля, температури, електричного опору. Кожна енергосистема і орган зв’язані зі своєю групою акупунктурних точок, серед яких є, так звані, репрезентативні точки (ті, що несуть максимум достовірної інформації про свою систему). Отже, енергетичний стан деяких меридіанів опосередково дає можливість судити про ознаки ураження ГМ при АГ.
З точки зору традиційної китайської медицини АГ чи ГХ, а також ГДЕ розглядаються як сидром надмірності „ЯН”. В переважній більшості літературних джерел (Мачерет Є.Л. і співав., 1989; 2002) вказується на синдром підйому „вогню” печінки. Аналіз даних діагностики по Накатані у обстеженого нами контингенту хворих показав неоднорідність меридіанних порушень та мозаїчність акупунктурних синдромів.
Звертає на себе увагу той факт, що в стані надмірності уобстеженого контингенту хворих за даними електропунктурної діагностики в основному перебували такі меридіани: серця С(V) – 53,2%; сечового міхура V(VІІ) – 39,7%; перикарду MC(ІX) – 51,3%; трьох світильників TR(X) – 47,4%. Надмірність у меридіані печінки F(ХІІ) в більшій мірі зустрічається у пацієнтів з кризовим перебігом ГХ – 34,9%.
Чіткої картини з приводу недостатності по меридіанах не виявлено, хоча в більшості випадків вона зустрічається в меридіанах легень Р(І), товстої GI(II) та тонкої кишки IG(VI), нирок R(VІІІ).
Дані про дисбаланс в меридіанах наведені в таблиці 10.
Характерною ознакою надмірності “ЯН” меридіанів є клінічна забарвленість хвороби, тобто локалізація головного болю чітко підтверджується топографією контрольованих ділянок надмірних „ЯН” меридіанів. Так надмірність меридіану сечового міхура V(VІІ) характеризується запамороченням, головним болем та важкістю в потилиці, надмірність меридіану жовчного міхура VB(ХІ) – головний біль, відчуття стискання і пульсації у скроневій ділянці, надмірність в меридіані шлунку Е(ІІІ) – головний біль та відчуття важкості в лобній ділянці.
Якщо звернути увагу на кількісні показники, то відмічається зміщення „фізіологічного коридору” по карті вниз у переважної більшості хворих, що свідчить про зниження електропровідності, вегетативного забезпечення і, відповідно, компенсаторно-адаптаційних можливостей.
Таблиця 10.
Дані електропунктурної діагностики по Накатані у хворих з ГДЕ
|
Меридіани |
Хворі з ГДЕ І-ІІ ст.
|
|
|
Надмірність |
Недостатність |
|
|
Легень Р(І) |
6,4% |
33,3% |
|
Товстої кишки GI(ІІ) |
28,8% |
35,9% |
|
Шлунку Е(ІІІ) |
23,1% |
6,6% |
|
Селезінки RP(IV) |
13,5% |
16% |
|
Серця C(V) |
53,2% |
3,2% |
|
Тонкої кишки IG(VI) |
7,4% |
41,7% |
|
Сечового міхура V(VII) |
39,7% |
4,5% |
|
Нирок R(VIIІ) |
7,7% |
34,6% |
|
Перикарду МС(ІХ) |
51,3% |
7,4% |
|
Трьох світильників TR(X) |
47,4% |
12,8% |
|
Жовчного міхура VB(XI) |
27,6% |
3,2% |
|
Печінки F(XII) |
34,9% |
10,9% |
Контрольні питання до розділу.
Поряд з своєчасною та достовірною діагностикою ДЕ не меншою проблемою залишається правильний вибір ефективного лікування (Суслина З.А., Варакин Ю.Я., Верещагин Н.В., 2006), що може бути запорукою запобігання тяжких ускладнень цереброваскулярної патології, які приводять до інвалідизації, а нерідко і до смерті. Аналіз літературних джерел показав, що на сьогоднішній день медикаментозна терапія є пріоритетною в ангіоневрології. Враховуючи складність патогенетичних механізмів ДЕ (Ганнушкина И.В., 1996), в процесі лікування необхідно добиватися нормалізації системного та мозкового кровообігу, скоректувати порушення різноманітних видів обміну речовин мозкової тканини, а також стан гемореології та гемокоагуляції. Але в цей же час важливим залишається мінімізація медикаментозної та немедикаментозної терапії, що має не тільки медичне, але і соціальне значення.
Основні терапевтичні заходи у хворих з ДЕ повинні бути спрямовані на основний патологічний процес (в нашому випадку АГ), покращення церебральної гемодинаміки і підвищення функціональних можливостей мозку (Gorelick P.B., Alter M., 2002; Jokasalo E. et al., 2002; Суслина З.А., Варакин Ю.Я., Верещагин Н.В. 2006)). Безперечно, лікування хворих з ГДЕ повинно бути комплексним (Віничук С.М., 1999; Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В., 2006), з врахуванням компенсації серцево-судинних порушень, відновлення мікроциркуляції та застосування принципів метаболічної терапії.
3.1. Відновлення центральної гемодинаміки.
В основі лікувальної тактики при ДЕ лежать методи, що дозволяють відновити нормальну роботу серця і прийнятних цифр АТ. Важко розраховувати на успіх лікувальних заходів при наявності у хворого грубих порушень центральної гемодинаміки. Корекція центральної гемодинаміки – необхідна умова ефективної терапії ДЕ.
На гіпотензивній терапії хотілось зупинитись більш детально, так як основні лікувальні рекомендації стосовно тактики ведення хворих з АГ зустрічаються у навчальних керівництвах по кардіології. Однак, в період реформування медичної освіти та підготовки фахівців широкого профілю (сімейна медицина), необхідний певний рівень знань і неврологам в цьому питанні.
Основні принципи лікування АГ (згідно з рекомендаціями Української асоціації кардіологів, 2004):
Яка ж тактика лікаря при виявленні підвищення АТ? Перш за все необхідно провести стратифікацію ризику. Під цим терміном розуміють ризик ускладнень, який має хворий внаслідок підвищення АТ, а також наявність супутніх захворювань, ураження органів-мішеней. Виділяють декілька груп ризику (зображені в табл. 11).
Таблиця 11.
Діагностичні критерії стратифікації ризику
|
Категорія ризику |
Діагностичні критерії |
|
Низький ризик (ризик 1) |
1 ступінь АГ; немає факторів ризику, немає ураження органів-мішеней, немає асоційованих захворювань |
|
Середній ризик (ризик 2) |
2 – 3 ступінь АГ; немає факторів ризику, немає ураження органів-мішеней, немає асоційованих захворювань.
1 – 3 ступінь АГ; є один і більше факторів ризику, немає ураження органів-мішеней, немає асоційованих захворювань |
|
Високий ризик (ризик 3) |
1 – 3 ступінь АГ; є ураження органів-мішеней +/_ інші фактори ризику; немає асоційованих захворювань |
|
Дуже високий ризик (ризик 4) |
1 – 3 ступінь АГ; +/- цукровий діабет; +/- інші фактори ризику; Є асоційовані хвороби |
У групах високого й дуже високого ризику поряд із здійсненням немедикаментозної програми лікування рекомендується невідкладно починати медикаментозну терапію (Свіщенко Є.П., 2004). Тривалість немедикаментозного лікування до призначення антигіпертензивних препаратів у групі середнього ризику становить 6 місяців, у групі низького ризику - 12 місяців (табл. 12). Високий нормальний АТ (130-139/85-89 мм.рт.ст.) у хворих із цукровим діабетом, хронічною нирковою недостатністю, серцевою недостатністю вимагає ранньої активної медикаментозної терапії.
Таблиця 12.
Ступінь ризику і тактика лікування АГ
|
Ступінь АГ |
Група ризику 1 |
Група ризику 2 |
Група ризику 3 й 4
|
|
Високий нормальний АТ(130-139/85-89 мм. рт. ст.) |
Зміна способу життя |
Зміна способу життя |
Медикаментозна терапія ** |
|
Ступінь 1 (140-159/90-99 мм. рт. ст.) |
Зміна способу життя (12 міс.); Немає ефекту - медикаментозна терапія |
Зміна способу життя (6 міс.)*; Немає ефекту - Медикаментозна терапія |
Медикаментозна терапія |
|
Ступінь 2 й 3 (>160/100 мм. рт. ст.) |
Медикаментозна терапія |
Медикаментозна терапія |
Медикаментозна терапія ** |
Примітка:
* при наявності декількох факторів ризику вже на початковому етапі обговорити доцільність медикаментозної терапії;
** при наявності цукрового діабету, хронічної ниркової недостатності, серцевої недостатності.
При проведенні антигіпертензивної терапії варто намагатись досягти повної нормалізації АТ, тобто зниження до рівня нижче 140/90 мм.рт.ст., а у хворих на цукровий діабет – 130/80 мм.рт.ст. Необхідно підкреслити неприпустимість досягнення в короткий термін цільових значень АТ в більшості випадків, з використанням короткодіючих засобів й особливо з появою й/або збільшенням симптомів регіонарної недостатності кровообігу. Тривалість періоду досягнення цільового АТ 6-12 тижнів. Зміна антигіпертензивної терапії за умови її хорошої переносимості рекомендується не раніше, ніж через 4 - 6 тижнів.
Ризик розвитку серцево-судинних ускладнень в ближчі 10 років складає:
Отже, в лікуванні АГ виділяють препарати першої лінії: діуретики, β–адреноблокатори, інгібітори АПФ, антагоністи кальцію тривалої дії, антагоністи рецепторів ангіотензину ІІ. Альтернативою монотерапії препаратами першої лінії є низькодозовані комбінації двох препаратів першої лінії.
Препаратами другої лінії є: α1 –адреноблокатори, алкалоїди раувольфії, центральні α2 – агоністи (клонідін, метилдопа та ін.), прямі вазодилятатори (гідралазин).
Ми більш детально зупинимось на препаратах першої лінії.
Діуретики
Ці препарати широко застосовуються, завдяки хорошій переносимості, помірній ціні. Доведено, що тіазидові та тіазидоподібні діуретики (гідрохлортіазид 6,5-12,5 мг на добу одноразово, індапамід (арифон) 2,5 мг на добу за 1 прийом) запобігають розвитку серцево-судинних ускладнень при АГ, особливо мозкового інсульту. Застосовуються також калійзберігаючі діуретики – спіронолактон 25-50 мг на добу за 2-3 прийоми, тріамтерен 50-100 мг на добу за 1-2 прийоми. Основними особливостями АГ, які потребують призначення діуретиків є:
Оптимальна комбінація діуретиків з β–адреноблокаторами. Негативні ефекти спостерігаються при застосуванні високих доз, зокрема, це гіпокаліємія, гіперглікемія та дисліпідемія, причому, індапамід є винятком, тобто метаболічно нейтральним (показаний при цукровому діабеті). Протипоказом до застосування діуретиків є подагра, гіпокаліємія, аденома передміхурової залози, сексуально активні чоловіки (відносний протипоказ).
β–Адреноблокатори
Перевагу надається препаратам пролонгованої дії(атенолол 25-100 мг на добу за 1-2 прийоми, бісопролол (конкор) 5-10 мг на добу за 1 прийом, метопролол (беталок) 50-100 мг на добу за 1-2 прийоми).
Препарати цієї групи також сприяють зниженню серцево-судинної захворюваності та смертності, вони запобігають порушенню коронарного кровообігу, зокрема у осіб, які перенесли інфаркт міокарда). β–адреноблокаторам слід надавати перевагу за наявності таких особливостей хворого:
- молодий та середній вік;
- ознаки гіперсимпатикотонії (тахікардія, високий пульсовий тиск);
- при тахіаритміях;
- супутня ішемічна хвороба серця;
- гіпертиреоз;
- мігрень;
- гіпертензія у передопераційному та післяопераційному періоді.
Препарати цієї групи безпечні та відносно недорогі, комбінуються з діуретиками та антагоністами кальцію, також обговорюється можливість їх використання при вагітності (з 3-го триместру). Небажаними ефектами є бронхоконстрикція і негативний вплив на метаболізм глюкози і ліпідів. Призначення більшості β–блокаторів протипоказане при серцевій недостатності, гіперліпідемії, цукровому діабеті, бронхіальній астмі, деяких порушеннях серцевого ритму. Виключенням є селективний β–блокатор конкор, який особливо рекомендують при АГ з порушенням серцевого ритму.
Інгібітори АПФ
Препарати цієї групи (лізинопри (діротон) 5-20 мг на добу за 1-2 прийоми, еналаприл (енап, ренітек, едніт) 5-20 мг на добу за 1-2 прийоми, престаріум (періндоприл) 4-8 мг на добу за 1-2 прийоми та ін.) використовуються для лікування як м’якої, так і тяжкої гіпертензії, особливо ефективні у тих, хто приймає діуретики, оскільки діуретики підвищують рівень реніну та активність системи ренін-ангіотензин у крові. Препарати цієї групи запобігають ремоделюванню лівого шлуночка при інфаркті міокарду, попереджують розвиток діабетичної нефропатії у хворих з цукровим діабетом. Перевагу у призначенні інгібіторів АПФ слід надавати у таких випадках:
- супутня серцева недостатність;
- ренопаренхіматозна гіпертензія;
- гіпертрофія лівого шлуночку;
- перенесений інфаркт міокарду, мозковий інсульт або транзиторне порушення мозкового кровообігу.
Основні побічні дії – гіпотонія 1-ї дози та сухий кашель. Препарати протипоказані при вагітності, гіперкаліємії, двохсторонньому стенозі ниркових артерій, тяжкому стенозі устя аорти або мітральному стенозі, нейтропенії. Оскільки інгібітори АПФ мають калійзберігаючий ефект, то їх не рекомендують комбінувати з калійзберігаючими діуретиками (триампур, верошпірон, альдактон). Найбільш оптимальна їх комбінація з арифоном, тим більше, що він може застосовуватись при цукровому діабеті, який часто супроводжує АГ.
Антагоністи кальцію
До цієї групи входять такі препарати, як верапаміл 120-480 мг на добу за 1-2 прийоми, дилтіазем 120-540 мг на добу за 1-2 прийоми, амлодипін (норвакс, нормодипін) 5-10 мг на добу за 1-2 прийоми та ін. Перевагу препаратам цієї групи слід надавати при:
- середньому та похилому віці;
- ізольована систолічна гіпертензія;
- цукровий діабет (з протеїнурією);
- дисліпідемія;
- ураження паренхіми нирок;
- стабільна стенокардія;
- суправентрикулярна тахікардія та екстрасистолія (верапаміл, дилтіазем);
- порушення периферичного кровообігу.
Антагоністи кальцію протипоказані при серцевій недостатності та АВ блокаді ІІ-ІІІ ступеня. Слід застосовувати лише препарати з пролонгованою дією, оскільки є дані, які свідчать про збільшення ризику інфаркту міокарда та підвищення смертності у осіб похилого віку. Антагоністи кальцію, на відміну від діуретиків та β-адреноблокаторів, є метаболічно нейтральними, тобто не впливають на толерантність до глюкози та рівень ліпідів у крові. В експериментальних дослідженнях на тваринах було показано нейропротекторну дію антагоністів кальцію у хворих з АГ (Amenta F. etal., 2002).Однак, препарати цієї групи впливають і на церебральні судини, що забезпечує покращення мозкового кровотоку, але в деяких випадках може спровокувати підвищення внутрішньочерепного тиску. Інколи віддиференціювати головний біль зумовлений підвищенням внутрішньочерепного тиску досить важко, так як цефалгія – основний симптом ДЕ. Тому антагоністи кальцію з обережністю слід призначати хворим з внутрішньочерепною гіпертензією.
Блокатори рецепторів ангіотензину II (лозартан (козаар) 25-50 мг на добу за 1 прийом, кандесартан (кандесар) 8-32 мг на добу одноразово).
Препарати близькі за своїм механізмом дії до інгібіторів АПФ. Як правило вони не викликають кашлю та ангіоневротичного набряку. Відсутність істотних побічних ефектів є особливістю цього класу препаратів. Препарати ефективні при одноразовому прийомі, дія підсилюється при поєднанні з діуретиками. Група цих препаратів показана при:
Протипоказання до застосування цих препаратів: вагітність, гіперкаліємія, двосторонній стеноз ниркових артерій.
останнім часом змінились пріоритети у призначенні антигіпертензивних препаратів. Якщо раніше діуретики і β-блокатори були засобами вибору, то сьогодні вони займають останнє місце серед препаратів першої лінії. Для профілактики розвитку гострого порушення мозкового кровообігу та повторних інсультів найбільш показані блокатори рецепторів ангіотензина ІІ. Блокатори ангіотензина ІІ попереджують розвиток інсульту за рахунок подвійного механізму (блокада АТ1-рецепторів і стимуляція АТ2-рецепторів), завдяки чому попереджається розвиток атеросклеротичної бляшки.
Ауторегуляцію мозкового кровообігу при цереброваскулярних захворюваннях не порушують інгібітори АПФ, блокатори рецепторів ангіотензину ІІ та блокатори кальцієвих каналів. Важливим ще є те, що блокатори кальцієвих каналів добре поєднуються з інгібіторами АПФ, так і з блокаторами рецепторів ангіотензина ІІ.
Комбінована терапія необхідна 50-75 % хворим з АГ. У випадку неефективності монотерапії не слід збільшувати дозу до максимальної, оскільки це підвищує вірогідність побічних ефектів. Краще використовувати комбінацію з 2-х, а при необхідності 3-4-х препаратів. Комбіноване лікування необхідне більш, ніж в 50% хворих з АГ.
Рекомендовані комбінації гіпотензивних препаратів:
ДІУРЕТИК + β-АДРЕНОБЛОКАТОР
ДІУРЕТИК + ІНГІБІТОР АПФ (або БЛОКАТОР АТ-РЕЦЕПТОРІВ)
АНТАГОНІСТ КАЛЬЦІЮ + β-АДРЕНОБЛОКАТОР
(ДИГІДРОПІРИДІНИ)
АНТАГОНІСТ КАЛЬЦІЮ + ІНГІБІТОР АПФ
α1–АДРЕНОБЛОКАТОР + β-АДРЕНОБЛОКАТОР
Таблиця 13.
Комбіновані антигіпертензивні препарати
|
Назва |
Склад |
|
Ноліпрел Ноліпрел форте Адельфан Адельфан-езидрекс Віскальдикс Гізаар Еналозид Енап-Н Енап-НІ Капозид Каптопрес Ко-ренітек Кристепін Ліпразид Модуретик Норматенс Синепрес Тенорик Триампур Трирезид К Хомвіотензин |
Периндоприл 2 мг + індапамід 0,625 мг Периндоприл 4 мг + індапамід 1,25 мг Резерпін 0,1 мг + дигідралазину сульфат 10 мг Резерпін 0,1 мг + гідрохлортіазид 10 мг + дигідралазину сульфат 10 мг Піндолол 10 мг + клопамід 5 мг Лозартан 50 мг + гідрохлортіазид 12,5 мг Еналаприл 10 мг + гідрохлортіазид 25 мг або 12,5 мг Еналаприлу малеат 10 мг + гідрохлортіазид 25 мг Еналаприлу малеат 10 мг + гідрохлортіазид 12,5 мг Каптоприл 25 або 50 мг + гідрохлортіазид 25 мг Каптоприл 50 мг + гідрохлортіазид 25 мг або 12,5 мг Еналаприлу малеат 20 мг + гідрохлортіазид 12,5мг Резерпін 0,1 мг + клопамід 5 мг + дигідроергокристин 0,58 мг Лізиноприл 10 або 20 мг + гідрохлортіазид 12,5 мг Амілориду гідрохлорид 5 мг + гідрохлортіазид 50 мг Клопамід 5 мг + дигідроергокристин 0,5 мг + резерпін 0,1 мг Резерпін 0,1 мг + гідрохлортіазид 10 мг + дигідроерготоксин 0,6 мг Атенолол 100 мг + хлорталідон 25 мг Триамтерен 25 мг + гідрохлортіазид 12,5 мг Резерпін 0.1 мг + гідрохлортіазид 10мг + дигідралазину сульфат 10 мг Резерпін 0,032 мг + раувольфія 0,032 мг + глід 0,064 мг + омела біла 0,032мг |
Отже, підбір гіпотензивної терапії на початкових етапах включає препарати першої лінії, при чому підбирають ту групу, яка буде більш ефективна у даного пацієнта. На відміну від рекомендацій Європейського та Українського товариств з кардіології в США запропонована нова класифікація АГ і першим препаратом при неускладненій АГ є тіазидовий (тіазидоподібний) діуретик (для монотерапії або для комбінації з іншими препаратами). Інші антигіпертензивні препарати рекомендують за показами у осіб з високим ризиком. Така тактика скоріш за все обумовлена проведеними дослідженнями, які показали, що у хворих з АГ тіазидові (тіазидоподібні) діуретики дають найкращий ефект щодо поліпшення прогнозу, а також більш ефективно запобігають розвитку інсульту. Але такі результати слід оцінювати з врахуванням демографічних особливостей хворих (значне представництво осіб чорної раси та літніх людей) (Свіщенко Є.П. і співав., 2005).
Не можна забувати, що у хворих з тривалою АГ значно порушується реактивність мозкових судин, знижується здатність артеріол до вазодилятації. Нижня межа ауторегуляції мозкового кровотоку підвищується з 60 до 85 мм.рт.ст., що стає причиною поганого самопочуття у відповідь на гіпотензивні реакції (Lewington S. etal., 2002). Результати великих контрольованих досліджень, проведених в останні роки з використанням методу добового моніторування АТ, переконливо підтверджують клінічні спостереження про те, що надмірне зниження АТ, у тому числі й уночі (спонтанне або викликане агресивною антигіпертензивною терапією), особливо в літніх осіб з АГ, є чинником ризику розвитку судинних уражень мозку. Так, при спостереженні протягом 3,4 років 575 літніх хворих з АГ встановлено, що при нічному рівні ДАТ < 75 мм.рт.ст. (на фоні лікування АГ) частота інсультів була більшою, ніж при ДАТ > 75 мм.рт.ст. Результати великого японського дослідження Ohasama показали, що кількість інсультів у дипперів на фоні терапії було вірогідно більшою, ніж у нондипперів.
3.2. Відновлення церебральної гемодинаміки
Покращення церебральної гемодинаміки традиційно асоціюється з призначенням вазодилятаторів та вазоактивних препаратів (Скоромец А.А. и соавт., 2005; Мироненко Т.В. и соавт., 2005; Марута Н.А. и соавт., 2005) – лікарських препаратів, що розширюють внутрішньомозкові артерії та покращують мікроциркуляцію. Група медикаментозних засобів, що застосовують з цією метою, досить широко представлена. Широке застосування знайшли похідні малого барвінка (кавінтон, вінпоцетин), ксантина (теофіллін, пентоксифіллін та ін.), препарати нікотинової кислоти.
Вінпоцетин- таблетки по 5 мг або в дозі 10 мг, має судиннорозширюючу, антиагрегаційну функції, вибірково покращує метаболізм та перфузію головного мозку, покращує мікроциркуляцію і не викликає феномену „обкрадання”. При виражених цереброваскулярних порушеннях лікування рекомендовано починати з внутрішньовенних інфузій в дозі 20 мг на 200-250 мг фізіологічного розчину, далі переходять на пероральний прийом таблеток по 5 мг 3 рази на добу протягом 2-3 місяців. Клінічна ефективність більше проявляється по відношенню до когнітивних порушень та вестибуло-координаторних розладів. З обережністю слід призначати препарати у хворих з серцево-судинною патологією: серцева недостатність, порушення серцевого ритму.
Циннарізин 25 мг – блокатор кальцієвих каналів з переважним впливом на судини ГМ, залишається одним із найбільш часто вживаних препаратів при цереброваскулярній недостатності. Знижує тонус гладеньких м’язів артеріол та зменшує збудливість вестибулярного апарату, протипоказаний при паркінсонізмі.
Позитивний ефект спостерігається у хворих на ДЕ при застосуванні еуфіліну, зокрема при явищах венозної дисциркуляції, у хворих з вадами розвитку серця, серцево-легеневою недостатністю, беталепсією. Можливий пероральний прийом препарату (таблетки по 0,15 г), а також парентеральне його введення – по 5 мл 2% розчину.
Вигідно відрізняється від інших препаратів пентоксифілін, в механізмі дії якого важливе місце займає сприятливий вплив на еластичність мембран еритроцитів та тромбоцитів, що покращує кровотік, мікроциркуляцію та метаболізм мозкової тканини. Окрім суб’єктивного покрашення стану, препарат знижує рівень холестерину, підвищує фібринолітичні властивості крові. Препарат випускають у формі драже по 100 мг, в ретардній (пролонгованій) формі по 400 і 600 мг, а також в ампулах по 2 мл 5% розчину. Впровадження ретардної форми підвищило його ефективність в лікуванні пацієнтів з хронічними захворюваннями.
Ніцерголін покращує мозковий та периферичний кровообіг, метаболізм мозку, має реологічні властивості. Випускається в таблетованій формі по 5 і 10 мг, інколи викликає гіпотензію.
Особливої уваги заслуговує препарат Танакан, який містить екстракт гінкго білоби (EGb 761). Танакан (EGb 761) являє собою стандартизований і титрований екстракт із натуральної сировини, основними діючими речовинами якого є флавонові глікозиди й терпенові речовини. Багаточисленні дослідження свідчать про те, що ці речовини мають різноспрямований позитивний вплив на мікроциркуляцію, а також володіють антигіпоксичним ефектом (запобігає утворенню вільних радикалів і перекисному окисленню ліпідів клітинних мембран), що служить підставою для застосування Танакана при судинних захворюваннях головного мозку й порушеннях периферичного кровообігу.
Танакан (EGb 761) виявляє регулюючий вплив на судинну систему, стимулює вироблення ендотелійзалежного послаблювального фактора, розширює дрібні артерії, підвищує тонус вен, тим самим регулює кровонаповнення судин. Зменшує проникність судинної стінки (протинабряковий ефект – як на рівні головного мозку, так і на периферії).
EGb 761 впливає на всі судини мікроциркуляторного русла, причому більшою мірою на спазмовані або склеротично змінені судини, відповідно не викликає “ефекту обкрадання”. Вазоактивна ефективність препарату показана в багатьох дослідженнях (Яхно Н.Н. и соавт., 1998; Kleijnen J, Knipschild P., 1992), існують дані про наявність у Танакана антиагрегантного й антигіпоксичного ефектів. Антиагрегантна дія зумовлена впливом на стабілізацію мембран тромбоцитів і еритроцитів, на синтез простагландинів та зниженням дії біологічно активних речовин і тромбоцитоактивуючого фактора.
Цінність препарату також зумовлена позитивним впливом на когнітивні функції пацієнтів із цереброваскулярною патологією. Варто підкреслити, що, за даними ретроспективного дослідження EPIDOS, літні особи, які тривалий час застосовували Танакан, мали вірогідно менший ризик розвитку деменції, чим ті, які приймають інші судинні препарати або взагалі не одержують лікування (AndrieuxS. etal., 2001). Дослідження проведені Яхно Н.Н. і співав. (1998) показали, що застосовування Танакана у хворих з ранніми формами хронічних порушень мозкового кровообігу позитивно впливає на обсяг запам’ятовування й відтворення, концентрацію й стійкість уваги, асоціативні процеси, психомоторні функції.
Однак, найважливішою характеристикою Танакана є досить сприятливий профіль безпеки й переносимості, що дозволяє застосовувати його протягом тривалого часу, не побоюючись заподіяння якої-небудь шкоди здоров’ю.
Танакан призначають по 1 таблетці або 1 мл (розчин для перорального застосування) 3 рази на добу під час їжі. Середня тривалість курсу лікування – 3 місяці.
Вазобрал - комбінований препарат, в склад якого входять дигідроергокриптин та кофеїн. Дигідроергокриптин блокує α1- і α2-адренорецептори гладеньких м’язів судин, а також рецептори тромбоцитів, еритроцитів, має стимулюючий ефект на допамінергічні та серотонінергічні рецептори ЦНС. Завдяки цьому препарат зменшує агрегацію тромбоцитів та еритроцитів, знижує проникливість судинної стінки, покращує кровообіг і метаболізм в ГМ, підвищує стійкість тканини мозку до гіпоксії. Відмічається також вегетостабілізуючий ефект вазобралу, який проявляється нормалізацією тонусу судин, покращенням венозного відтоку, завдяки впливу на симпатичну нервову систему при зниженні парасимпатичної. Призначають препарат в дозі 2-4 мл або 1 таблетка 2 рази в день протягом 2-3-х місяців.
Оксібрал – містить вінкамін, має селективну вазорегулюючу дію на мозкові судини, сприяючи адаптації мозкового кровотоку до метаболічних потреб мозку, поліпшує метаболізм мозку за рахунок підсилення окислювання глюкози, збільшуючи тим самим утворення енергії й сприяючи підвищенню загальної активності. Оксібрал збільшує постачання киснем нейронів, що перебувають у стані гіпоксії, нормалізує мозковий кровообіг, знижує й стабілізує опір судин головного мозку, підвищує функціональну активність мозку, впливає на інтелектуально-мнестичні функції. Застосовують по 1 капсулі (містить 30 мг вінкаміну) двічі на день, або по у вигляді розчину – 2 мл (15 мг вінкаміну) внутрішньом’язево чи внутрішньовенно крапельно на фізіологічному розчині.
За останні роки успішно використовують нові препарати, що переважно впливають на тонус дрібних артерій (триметазидин). Триметазидин – таблетки по 20 мг - діє на клітинному рівні, нормалізуючи енергетичний баланс у клітинах при гіпоксії, запобігає зниженню внутрішньоклітинного вмісту АТФ. Підтримує клітинний гомеостаз, забезпечуючи нормальне функціонування іонних каналів мембрани й трансмембранний транспорт іонів калію. Препарат підвищує толерантність до фізичних навантажень, не впливаючи на частоту серцевих скорочень, знижує частоту приступів стенокардії; поліпшує переносимість вестибулярних проб, підвищує гостроту слуху, послабляє інтенсивність шуму у вухах, ефективно зменшує ступінь, тривалість і частоту приступів запаморочення при хворобі Меньєра й запамороченні судинного походження. Застосовують препарат по 1 таблетці 2-3 рази в день, тривалість курсу підбирається індивідуально.
Арсенал „судиннорозширюючих” препаратів для лікування цереброваскулярної недостатності дуже великий. Але для їхнього ефективного застосування важлива оптимізація різних напрямків комплексної терапії. По-перше, необхідно уникнути дублювання судинорозширювальних ефектів препаратів різних фармацевтичних груп. По-друге, до призначення вазодилятаторів з метою поліпшення мозкового кровообігу, доцільно переконатися, що резерв цереброваскулярної реактивності не вичерпаний (Волкова И.И. и соавт., 2000;Кабанов А.А., 2000). Чи здатні атеросклеротично змінені артерії відповідати на судинорозширювальні стимули? Якщо не здатні, виходить, єдиний шлях поліпшення мозкового кровотоку пов’язаний з відновленням мікроциркуляції.
3.3. Корекція мікроциркуляторних порушень
Мікроциркуляторний блок – часта й найбільш значима причина ДЕ. Порушення мікроциркуляції в літніх зв’язано як зі станом судин (ендотеліальна дисфункція), так і зі змінами крові (Манвелов Л.С., Кадыков А.С., 2000). Гіперкоагуляція характерна для хворих з АГ або може бути обумовлена іншими причинами, найбільш значимі з яких: зниження фібринолітичних властивостей крові, підвищена агрегація тромбоцитів, ендогенна інтоксикація. Підвищення в’язкості крові пов’язане з підвищенням в’язкості плазми (гіперглікемія, гіперфібриногенемія, гіперхолистеринемія) або збільшенням кількості й агрегації формених елементів крові (частіше еритроцитів) (Грицай Н.Н., Мищенко В.П., 2000). Еритроцитоз характерний для хронічних захворювань легень, серцевої недостатності, він звичайно виявляється в курців. Еритроцитарний мікроциркуляторний блок обумовлений не тільки збільшенням числа червоних кров’яних тілець, але й порушенням їх деформованості, зміною властивостей еритроцитарних мембран. Сучасна терапія мікроциркуляторних розладів базується на результатах лабораторних досліджень гемостазу й реології крові. Якщо мікроциркуляторні порушення обумовлені внутрішньосудинним тромбоутворенням – для лікування використають дезагреганти. Еритроцитарний мікроциркуляторний блок усувається похідними ксантина або орто-таурином.
Діпірідамол– тормозить агрегацію тромбоцитів, покращує мікроциркуляцію, застосовується в таблетованій формі по 25 мг 3 рази в день, препарат також має вазоактивні властивості – зменшує периферичний опір коронарних та мозкових артерій, знижує АТ. До деякої міри мікроциркуляторні порушення усуваються препаратами нікотинової кислоти внаслідок їхнього впливу на активацію фібринолізу.
При підвищеному ризику розвитку гострих порушень мозкового кровообігу використовують антиагреганти. Ацетилсаліцилова кислота – „золотий стандарт” антиагрегантної терапії, зменшує в’язкість крові та агрегацію тромбоцитів. Навіть в добовій дозі до 100 мг препарат ефективно інгібірує тромбоутворення. Можливі побічні ефекти з боку шлунково-кишкового тракту, щоб їх уникнути існують інші форми ацетилсаліцилової кислоти – аспірин-кардіо (таблетка покрита оболонкою, яка розчиняється тільки в кишечнику), кардіомагніл (в склад таблетки входить антацидний препарат – 75 мг аспірину і 10,5 мг гідроксида магнію).
Тіклопідін – знижує в’язкість крові, зменшує рівень фібриногену, має більшу антиагрегаційний ефект в порівнянні з аспірином. При прийомі препарату можливі побічні дії, зокрема нейтропенія, тромбоцитопенія, діарея, кровотечі виразкові. Призначають в дозі 250 мг 2 рази в день. Клопідогрель – схожий за своїми ефектами до попереднього препарату, однак містить менше побічних дій. Випускається в таблетках по 75 мг, вживається 1 раз в день.
3.4. Метаболічна терапія
Вплив на обмінні процеси ішемізованої тканини мозку може бути одним із провідних напрямків терапевтичної тактики при ДЕ (Ощепкова Е.В. 2004; Суслина З.А., Варакин Ю.Я., Верещагин Н.В., 2006). Можливість впливу на такі важливі процеси як оксидантне ушкодження клітини, проникність мембран, відновлення енергетичних можливостей виглядає надзвичайно привабливо. Необхідно лише пам'ятати, що реалізація терапевтичних зусиль, спрямованих на відновлення метаболізму нервової тканини можлива тільки при відновленні центральної гемодинаміки й усуненні мікроциркуляторних порушень.
Широке застосування в практиці знайшли антиоксиданти: вітаміни А, Е, С у різних комбінаціях або в комплексі, солкосерил й ін.
Мексидол– інгібірує процес перикисного окислення, збільшує активність ендогенних антиоксидантів, стабілізує тканинні мембрани, покращує кровообіг та мікроциркуляцію ГМ. Форма випуску: ампули 2 мл, таблетки по 125 мг. При ДЕ рекомендують внутрішньом’язеве введення препарату по 100 мг (2 мл) двічі в день, далі переходять на таблетки – 1-2 таблетки 2-3 рази в день (середня добова доза 250-500 мг). Обережно необхідно призначати хворим з АГ, зокрема з кризовим перебігом. Емоксіпін, як складова мексидолу, є антиоксидантом, має мембраностабілізуючу та антиагрегантну дію.
Однією із умов успішного лікування ДЕ варто вважати включення в програми лікування фосфоліпідних комплексів. Фосфоліпіди необхідні для побудови клітинних мембран і мієліну. Високу ефективність демонструють традиційні «активатори» метаболізму нервової тканини такі, як пірацетам й ін.. Пірацетам – похідна від γ-аміномасляної кислоти, оптимізує метаболічні процеси в нейронах, покращує когнітивні функції –пам’ять, увагу, розумову діяльність. Випускається в таблетках та капсулах в дозах 400, 800 та 1200 мг, для парентерального введення ампули 20 % розчину по 5 та 15 мл. Добова доза становить 1,2-2,4 г, курс лікування 1,5-2 місяці.
Пірітінол – ноотропний препарат, що має вплив на різні медіаторні системи: ацетилхолінергічну, серотонінергічну, дофамінергічну та ГАМКергічну. Препарат покращує пам’ять, пізнавальну функцію, психічну активність. Пірітінол приймають по 0,3-0,6 г на добу за 2-3 прийоми протягом декількох місяців. Ноотропна функція у препарату менш виражена, ніж у пірацетаму, однак його доцільно приймати у хворих з вираженим астенічним синдромом в перервах між курсами пірацетаму.
Прамірацетам – ноотропний препарат, який позитивно впливає на когнітивні функції, так як діє в холінергічних структурах головного мозку, завдяки чому підвищується функціональна активність нейронів. Прамістар не має седативної дії і не впливає на тонус вегетативної НС, застосовують по 1 таблетці 2 рази на добу.
Ноотропи впливають на метаболізм нервової тканини, мають вазоактивну та антигіпоксичну дію, а також ноотропні препарати різних груп об’єднує здатність викликати покращення інтегративної функції мозку за даними ЕЕГ: полегшення проходження інформації між півкулями, збільшення рівня бадьорості, збільшення абсолютної та відносної потужності спектру ЕЕГ кори і гіпокампу, збільшення домінуючого (Билоусов Ю.В., Мухина М.А., 2005). Препарати даної групи підвищують стійкість ЦНС до різноманітних порушень, полегшують процеси навчання і пам’яті, підвищують кортико-субкортикальний контроль.
Актовегін– олігопептидний препарат, активізує обмін речовин, стимулює процеси регенерації, завдяки покращенню доставки глюкози й кисню та їх утилізації клітинами ГМ. Препарат збільшує концентрацію ацетилхоліну, з яким пов’язана функція пам’яті. Сумарний ефект всіх процесів, які відбуваються завдяки впливу актовегіну, полягає в підсиленні енергетичного стану клітини, особливо в умовах гіпоксії та ішемії. Застосовується в таблетках по 200 мг або в розчинах для ін’єкцій по 2 та 5 мл – 40 мг, також 10 % та 20 % розчин для інфузій – 250 мл. Інколи можливі алергічні реакції, протипоказом є набряк легень, серцева недостатність ІІ-ІІІ стадії, олігурія.
В останні роки активно використаються комбіновані препарати (Бобров В. і співав., 2004; Міщенко Т.С., 2005), що становлять оптимальну комбінацію компонентів, що впливають на метаболізм нейронів, представником яких є фезам. Це комбінований препарат, що містить 400 мг пірацетама й 25 мг циннарізина. Сполучення двох компонентів підсилює антигіпоксичну дію й зменшує тонус гладкої мускулатури судин ГМ. Препарат володіє помірною антиагрегантною активністю, стимулює обмінні процеси в ЦНС, підвищує інтегративні здатності ГМ. Фезам має значно меншу кількість побічних ефектів, чим його окремі складові й ідеально підходить у тих випадках, коли застосування одного пірацетама викликає у хворого напруженість і безсоння, а циннарізина - сонливість.
Фармакологічний ефект тіоцетама обумовлюється взаємопотенціюючою дією тіотриазоліна й пірацетама. Препарат проявляє протиішемічну, антиоксидантну, ноотропну дію. Позитивно впливає на метаболічні процеси в ЦНС, стимулюючи обмін макроергічних з’єднань. Підвищує стійкість тканин мозку до гіпоксії й токсичних впливів, оптимізує споживання кисню й глюкози при недостатності кровопостачання й гострій церебральній ішемії, знижує вираженість вестибулярних розладів. Тіоцетам поліпшує асоціативні процеси, інтегративну діяльність мозку, стимулює процеси мислення й пам’яті, поліпшує здатність до концентрації й навчання. Застосовується в таблетованих формах по 1-2 таблетки 3 рази в день протягом 1 місяця, або у вигляді внутрішньом’язевихін’єкцій по 5 мл розчину, чи внутрішньовеннихінфузій – 10-30 мл препарату на 150 мл фізрозчину.
Інстенон (інстенон форте) – це також комбінований препарат, який містить три компоненти (вазоактивний компонент - етофілін, центральний стимулятор – етаміван, церебральний метаболік – гексобендін). Дія препарата полягає в стимуляції метаболізму мозку (підвищує утилізацію кисню та глюкози) і міокарду (збільшення хвилинного об’єму крові), а також нормалізується функціональний стан нейрональних комплексів. При виражених цереброваскулярних розладах можливий парентеральний прийом препарату (по 2 мл внутрішньовенно крапельно на 250 мл 5% глюкози чи фізіологічному розчині) з подальшим переходом на таблетовані форми (1-2 таблетки тричі в день, для інстенона форте – 1 таблетка 3 рази в день). Однією із найбільш частих побічних дій препарату можна назвати головний біль, який в більшості випадків, за нашими спостереженнями, стає причиною відміни інстенону.
Перспективний напрямок метаболічної терапії пов’язаний із застосуванням нейроспецифічних пептидів. Низькомолекулярні пептиди (церебролізин, цитаміни), отримані із тканини мозку володіють різноманітними ефектами в умовах хронічної церебральної ішемії. Вони сприяють відновленню міжнейрональних зв’язків, проявляють стимулюючу дію, сприяють відновленню втрачених функцій. Церебролізин – збалансований концентрат низькомолекулярних нейропептидів та вільних амінокислот, легко проникає через гематоенцефалічний бар’єр та потрапляє безпосередньо до нейронів. Препарат має нейротрофічний та репаративний ефект. Зменшує активність перекисного окислення. Призначають по 5-10 мл внутрішньовенно, можна внутрішньом’язево в дозі 5 мл. Курс складає 20-30 ін’єкцій або внутрішньовенних інфузій.
Цілком обґрунтованим варто вважати застосування при ДЕ регуляторних пептидів. З регуляторних пептидів, уже використовуваних у клінічній практиці варто згадати мелатонін. Мелатонін - низькомолекулярний пептид, продукт секреції шишкоподібної залози. Біологічна дія мелатоніна виходить далеко за рамки «регуляції циклу день-ніч». Він впливає на добові ритми АТ, бере участь в адаптації нейроендокринної системи до умов, що змінюються, зовнішнього середовища.
Велике значення в терапії цереброваскулярних захворювань надається застосуванню гомеопатичних препаратів: Церебрум композитум Н, Коензим композитум, Вертигохель. В основі антигомотоксичної терапії лежать принципи гомеопатії. Існують літературні дані, які свідчать про ефективність такого лікування: покращення когнітивних функцій – вербальна пам’ять, збільшення об’єму інформації, що засвоюється, зменшення вираженості виснаження (Мищенко Т.С., Шестопалова Л.Ф., Мищенко В.Н., 2004).
3.5. Симптоматичне лікування
Ми зупинялися в попередніх розділах на механізмі розвитку венозної дисциркуляції у хворих з ДЕ, тому застосування венотоніків часто є обґрунтованим у даної категорії пацієнтів. Одним із препаратів вибору є Гінкор форт, який має венопротекторну дію, підвищує тонус судин, регулює кровонаповнення вен, зменшує проникливість судинної стінки. В склад препарату входить екстракт листків гінкго білоби і троксерутин. Препарат застосовують по 1 капсулі 2 рази в день протягом 1місяця.
Наступним препаратом з венотонічною і ангіопротекторною дією є детралекс, який містить очищену флавонідну фракцію в мікронізованому вигляді, що дозволяє досягти швидкого результату. Спосіб застосування: 1 таблетка 2 рази в день, через один тиждень можна перейти на одноразовий прийом ліків, курс терапії 2 місяці. Ескузан (таблетки 20мг, краплі для перорального застосування) містить екстракт плодів кінського каштану, що забезпечує венотонічний і антиексудативний ефект. Застосовують препарат по 1 таблетці 3 рази в день, при необхідності можливий тривалий прийом.
Запаморочення, хитання при ході, порушення рівноваги – часті симптоми при ДЕ, особливо при розладах кровообігу в ВББ. Тому таким пацієнтам показані препарати, які пригнічують збудливість вегетативних центрів:
Для хворих з ДЕ. характерні емоційні розлади, серед яких переважають депресивні та астено-депресивні розлади. Так як депресію супроводжує астенія, то призначення антидепресантів є недоцільним. Перевагу надається призначенню інгібіторів зворотного захоплення серотоніну, які не мають вираженого седативного ефекту та інших побічних явищ, характерних для трициклічних антидепресантів.
До інгібіторів зворотного захоплення серотоніну належать:
До позитивних ефектів даної групи препаратів крім тимоаналептичної та анксіолічної дії можна віднести вегетостабілізуючу, що особливо цінним є у пацієнтів з проявами тривоги, страху, вегетативних пароксизмів. Інгібітори зворотного захоплення серотоніну не мають седативного та снодійного впливу, добре переносяться, можуть тривало використовуватись без побічних дій.
Одним із нових препаратів для лікування емоційних розладів є коаксил – атиповий трициклічний антидепресант. Препарат застосовується в дозі 12,5 мг - 1 таблетка три рази в день.
Для лікування астенічного синдрому використовують сальбутіамін 200 мг – добова доза 1-2-3 таблетки, курс лікування 1-2 місяці; препарат практично не викликає ускладнень.
Останнім часом для лікування астеній почали використовувати фенотропіл, який володіє адаптогенним, психостимулюючим, антидепресивним і анксіолітичним ефектами, і переважає за своїм ноотропним ефектом пірацетам, зменшує потребу у сні. В результаті застосування препарату спостерігаються наступні ефекти: збільшення інтегративної діяльності мозку, підвищення працездатності; покращення довгострокової та короткострокової пам’яті, уваги; підвищення стійкості до різних агресивних і екстремальних факторів; підвищення соціальної адаптації та якості життя. А при наявності патології ЦНС крім вище перерахованого властиві такі ефекти, як корекція вегетативних порушень, психоактивація при астенії без розвитку залежності й симптому відміни, швидкий і значний регрес осередкової симптоматики (Билоусов Ю.В., Мухина М.А., 2005). Препарат призначають по 50 мг 2 рази в день (другий прийом не пізніше 15 годин, так як це може викликати безсоння). Середня добова доза, яку поступово збільшують, становить 200-300 мг в день за два прийоми.
При наявності невротичних розладів застосовують денні транквілізатори – мезадепам,фенібут;рослинні препарати - новопасит.
Ще одним із симптомів характерних для хворих з ГДЕ є порушення сну, які характеризуються труднощами при засинанні (пресомнічні розлади); неспокійним поверхневим сном з просинаннями, деколи з тривожними сновидіннями (інтрасомнічні розлади); часте раннє просинання і відчуття незадоволення сном, розбитість після сну (постсомнічні розлади); сонливість вдень. З прогресуванням захворювання розлади сну поглиблюються.
Ефективні снодійні повинні відповідати наступним критеріям:
Останнім часом в клінічну практику лікування інсомній ввійшли снодійні небензодіазепінової групи, які відповідають вище перерахованим вимогам. Сюди віднесені такі препарати:
Не втратили своєї значимості і бензодіазепіни, які зменшують відчуття тривоги, неспокою і цим самим забезпечують швидке засипання та глибокий сон: феназепам 1-2 мг на ніч; нітразепам 5-10 мг на ніч; при безсонні спричиненій депресією показаний амітриптілін - 25-50 мг.
Основними принципами призначення снодійних є індивідуальний підбір, оптимізація дози, особливо дозу препарату необхідно контролювати у осіб похилого віку, інколи зменшуючи її вдвічі. Тривалість прийому одного снодійного не повинна перевищувати 3 тижні, якщо не вдалося досягти ефекту, то препарат необхідно замінити іншим. При необхідності тривалого застосування снодійних необхідно проводити так звані „медикаментозні канікули”, термін яких визначається індивідуально.
Таким чином, аналіз сучасних можливостей лікування ДЕ показує, що в більшості випадків ці можливості використаються не повною мірою. Доцільно весь цикл лікування розділити умовно на три періоди:
1) стабілізація центральної, церебральної гемодинаміки й мікроциркуляції;
2) застосування антиоксидантів, вітамінів, фосфоліпідних і пептидних комплексів;
3) застосування регуляторних пептидів і ноотропів.
Ефективним лікування ДЕ може бути тільки при тривалому застосуванні комплексних схем, що враховують дані додаткових досліджень, включаючи показники центральної й церебральної гемодинаміки, лабораторні тести, що відображають стан ліпідного обміну й гемостазу.
Даний перелік вказує на те, що основним засобом активації відновних процесів ЦНС є стимуляція всіх видів нейрометаболізму при підтримці адекватного кровотоку. Застосування вазоактивних та метаболічних препаратів дозволяє знизити ризик розвитку інсульту й уповільнити темп прогресування судинної патології мозку (Волошин П.В., Тайцлин В.И., 1991).
Контрольні питання до розділу.
Розділ 4. Акупунктура та лазеропунктура в лікуванні цереброваскулярних розладів.
Як говорилось вище, в терапії цереброваскулярної патології має місце і голкорефлексотерапія (ГРТ) та лазеропунктура (ЛП). Активний розвиток східної традиційної медицини з використанням можливостей сучасної медицини та діагностики привели до появи сучасної рефлексотерапії. Перевага рефлексотерапії над традиційною медикаментозною вагома: відсутність алергічних проявів, побічної дії, можливості передозування.
За літературними даними, а також за результатами деяких наших робіт, виявлено позитивний вплив методів рефлексотерапії на перебіг цереброваскулярної патології, та доцільність їх використання в комплексній терапії цієї патології (Мачерет Е.Л. и соавт., 1989; 2000; 2002; Козлов В.И. и соавт., 1995; Молодин В.И., 2000; Шувалова И.Н., 2000; Пеклун Н.В. и соавт., 2003; Марута Н.А. и соавт., 2005). Особливо всебічно вивчений вплив акупунктури (АП) на перебіг ГХ, що полягає в регуляції судинного тонусу (Мачерет Е.Л. и соавт., 1995; Бабіченко М.А., 2001).
Завдяки проведеним дослідженням, а також нашим спостереженням доведено, що ГРТ сприяє нормалізації фібринолітичної активності крові, імунобіологічних показників, може мати стимулюючу, регулюючу та нормалізуючу дію на загальну та системну реактивність організму, підвищувати його захисні сили, активізуючи функцію системи макрофагів, мієлоїдної та гіпофізарно-наднирникової системи, сприяючи рівновазі та рухливості основних нервових процесів, усуненню вегетативних, вегетативно-вісцеральних, та вегетативно-судинних порушень (Козлов В.И. и соавт., 1995; Бабіченко М.А., 2001; Мачерет Є.Л. і співав., 2005).
Одною із фундаментальних основ ГРТ є підтримка гомеостазу, здатність регулювання гіпо- і гіперфункції (Мачерет Є.Л., Коркушко О.О., 2003; Мачерет Є.Л. і співав., 2005). Вказані дані дозволяють зробити висновок, що АП більш швидко нормалізує психоемоційну сферу, створюючи більші можливості для реабілітації без побічної дії. За нашими даними АП впливає на перекисне окислення і цим самим веде до підсилення ефекту стабілізації клітинних мембран (Бабіченко М.А., 2001). При вивченні церебральної гемодинаміки під впливом АП з допомогою РЕГ та УЗДГ у хворих з цереброваскулярною недостатністю спостерігаються достовірні зміни, що проявляються у вигляді зменшення судинного опору, покращення венозного відтоку та покращення мозкового кровотоку (Ханенко Н.В., 2003; Мачерет Є.Л., Галич В.В., 2005; Siedentopf G.M. etal., 2005).
Останнім часом з’явилось багато праць присвячених вивченню дії ГРТ на вегетативну регуляцію ССС. Зокрема, наші дослідження показали істотне збільшення адаптаційних можливостей та резервів ССС, значне зниження компоненти VLF, тобто зменшення симпатичної активності, збільшення компоненти LF, що свідчить про підсилення барорефлекторних впливів, збільшення компоненти HF, тобто підвищення вагусних впливів на ВРС під впливом ГРТ (Бабіченко М.А., 2001; Ханенко Н.В., 2003; Паламарчук І.С., 2007).
Наші зарубіжні колеги у вивченні впливу ГРТ пішли дещо далі, зокрема це стосується об’єктивізації оцінки впливу. Так Fang J.L. etal. (2004) було проведено дослідження, яке полягало у вивченні ефективності дії голкою на ТА – F(ХІІ)3 і VB(ХІ)40 та на інші ділянки тіла, де немає будь-яких ТА за допомогою новітніх діагностичних методик. Результати показали активацію діяльності лобних доль, правої сторони таламусу і лівої – мозочка, характерним було підсилення ефекту від постійної стимуляції голки, шляхом її „підкручування”. Вище вказаних змін не було виявлено при стимуляції іншої ділянки, де не локалізовані ТА.
На нашій кафедрі було проведене дослідження (Бабіченко М.А., 2001), яке полягало у визначенні ефективності впливу на різні ТА, які використовують при АГ, шляхом вимірювання АТ, ЧССу спокої до проведення ГРТ та через кожні 5 хвилин впливу і по закінченні сеансу. Виявилося, що ГРТ впливає на АТ і ЧСС у хворих з ГХ по-різному: від значної дії до відсутності ефекту.Розташувавши середнє зниження АТ і ЧСС в порядку зниження, ми визначили, що максимальний гіпотензивний і ефект зменшення ЧСС притаманний впливу на ТА Е(ІІІ)9. Вколювання ТА GI(ІІ)4 практично не впливає на АТ і ЧСС, а вплив на точкиVВ(ХІ)20, V(VII)10 не впливає суттєво на ЧСС при значному гіпотензивному ефекті. Вплив на ТА: Е(ІІІ)9, Е(ІII)36, ТR(Х)5, МС(ІХ)6, GІ(II)11 достовірно знижує ЧСС і справляє гіпотензивний ефект.
Ми спробували простежити зв’язок між змінами показників гемодинаміки і змінами вегетативного тонусу під впливом ГРТ.Досліджувані нами ТА можна умовно розділити на дві групи. До першої віднесли точки VВ(ХІ)20, V(VII)10, GІ(ІІ)4, вплив на які підвищує представленість VLFспектру і знижує HFщо, на перший погляд, небажано для хворих на ГХ.
До другої групи віднесені ТА: Е(ІІІ)9, Е(ІІІ)36, GI(II)11, ТR(Х)5 і МС(IХ)6, голковколювання в які спричиняло значне зниження АТ, ЧСС, що супроводжувалося бажаним для хворих на ГХ зниженням активності симпатичної ланки вегетативної нервової системи і напруги регуляторних механізмів та підвищенням активності парасимпатичної ланки вегетативної нервової системи і барорефлексу. Щоб зрозуміти причину невідповідності змін показників гемодинаміки і вегетативного тонусу при голковколюванні в ТА першої групи були проаналізовані середні профілі вегетативного тонусу до і після впливу. Виявилось, щодо досліджуваної групи потрапили переважно хворі на ГХ із парасимпатикотонією. Останніх у досліджуваній групі було 21%, і більшості з них за довільним вибором голковколювання проводилася саме в ТА: VВ(ХІ)20,V(VІІ)10, GI(II)4. Завдяки аналізу вихідних спектрів і спектрів після ГРТ стає зрозумілим, що абсолютне збільшення VLFі зменшення HFє лише відносно небажаним тому, що це призводило до досягнення ейтонії чи до наближення до неї. В усіх інших дослідженнях (вплив на ТА ТR(Х)5, Е(Ш)9, Е(ІІІ)36, МС(ІХ)6, GI(II)11) зафіксовано в переважній більшості випадків досягнення гармонічного балансу - ейтонії при симпатикотонії в початковому стані (Бабіченко М.А., 2001).
Таким чином, ми виявили гармонізуючу дію ГРТ на вегетативний тонуc, показавшикорекцію найбільш зміненої ланки вегетативної нервової системи. Проте, вплив голковколювання у різні ТА на вегетативний тонус має певну специфічність, що необхідно враховувати при диференційованому призначенні ГРТ.
Викликає безсумнівний інтерес аналіз зміни хвильової структури серцевого ритму протягом сеансу голковколювання. Розглянемо це на прикладі точки Е(ІІІ)9. Протягом перших п’яти хвилин впливу тонус симпатичної ланки вегетативної нервової системи, при вихідній симпатикотонії ще більше збільшується. Однак до десятої хвилини дослідження показники відновлюються до вихідних, а до двадцятої хвилини досягається стан ейтонії (Бабіченко М.А., 2001). Показники АТ і ЧСС змінюються також поетапно. Усе це підтверджує постулати Традиційної Китайської Медицини та ГРТ про залежність ефекту від часу і методу впливу. Отже, у хворихз ГДЕ виникає необхідність гальмівного впливу (20 - 30 хвилин), зокрема при симпатикотонії.
Аналогічні чи схожі даніна вище описану залежність змін вегетативного тонусу від часу сеансу і методу впливу отримані також і при дослідженні інших точокПісля перших сеансів ГРТ спостерігалась тенденція до нормалізації вегетативного тонусу, а наприкінці курсу стабільне зменшення симпатичної активності і посилення барорефлекторних впливів. Після курсу ГРТ достовірно знижувався АТ та ЧСС, при чому їх динаміка корелювала з досягненням вегетативного балансу.
Також в літературі спостерігається багато робіт, присвячених вивченню впливу лазеротерапії на ССС. Перевага ЛП в порівнянні з ГРТ є вагомою: атравматичність, стерильність, скорочення часу на проведення процедури, використання у осіб з низьким порогом больової вразливості. Але недостатнє висвітлення механізмів дії лазера, робить ЛП емпіричним методом, народжує деякий скепсис у її лікувальних можливостях, перешкоджає широкому впровадженню у практику.
В основі механізму дії лазерного випромінювання лежить поглинання енергії світла атомами, молекулами сполук з перетворенням її на теплову, акустичну, механічну, електрохімічну енергію фотохімічних процесів, що впливає на біофізичні властивості тканин і біохімічні процеси, які відбуваються в них(Гамалея Н.Ф., 1996; Никитин А.В., Есауленко И.Э., Васильева Л.В., 2000; Шувалова И.Н., 2000). Тобто, низькоінтенсивне лазерне випромінювання (НІЛВ) діє на рівні клітинних мембран, що проявляється активацією окисно-відновних процесів (Пеклун Н.В., Поважная С.В., Шира А.И., 2003; Суслина З.А., Варакин Ю.Я., Верещагин Н.В., 2006). Під впливом ЛП в організмі виникають нервово-рефлекторні та нейрогуморальні реакції, активується симпато-адреналова система та імунна, збільшується концентрація адаптивних гормонів (Fang J.L. etal., 2005). Лазерне випромінювання покращує тонус і еластичність судин артеріального русла, збільшує рівень кровонаповнення мозкових і периферичних судин, сприяє регресу різноманітних вегетативно-судинних дисфункцій, покращує швидкість проведення моторного імпульсу по периферичних нервах (Гамалея Н.Ф., 1996; Мачерет Є.Л. і співав., 2001; 2003; Парнікоза Т.П., 2001 та ін.). НІЛВ дає судиннорозширюючий, стимулюючий, обезболюючий, протизапальний ефект, покращує обмін речовин, покращує біоенергетичні можливості на молекулярному рівні, на основі чого оптимізується регуляторні процеси.
Слід відмітити позитивний вплив лазеротерапії на мікроциркуляцію. Порушення мікроциркуляції як важлива патогенетична ланка включається в цілий ряд типових патологічних станів, зокрема при ГДЕ. Показано, що в основі біостимулюючого впливу НІЛВ лежать два процеси: безпосередня активація гемомікроциркуляції за рахунок збільшення локального тканинного кровотоку, і більш пролонгований процес, зв’язаний із новоутворенням капілярів (Козлов В.И. и соавт., 1995). При чому, стимулююча дія на мікроциркуляцію мало залежить від довжини хвилі, а в основному від поляризованості та когерентності. При щільності потужності 0,1-200 мВт/см2 можна досягнути стимуляції неоваскулогенезу, підвищення антиоксидантного статусу тканин і активації мікроциркуляції. Під впливом інфрачервоного лазерного випромінювання нормалізується тонус мікросудин, покращується капілярний кровотік, зменшуються застійні явища в посткапілярній ланці, значно знижується внутрішньосудинна агрегація, збільшується діаметр мікросудин, наростає щільність функціонуючих капілярів. Вище сказане нами підтверджується дані за допомогою таких методик, як телевізійна біомікроскопія капілярів нігтьового ложа, лазер-доплерівська флоуметрія та телевізійна біомікроскопія судин бульбарної кон’юктиви (Парнікоза Т.П., 2001; Мачерет Є.Л. і співав., 2005). А результати експериментальних досліджень підтверджують наявність резонансних частот для різних типів клітин, тканин, що є причиною диференційованого підходу до вибору методики лазеротерапії (Чейда А.А., Ефимова Е.Г., Каплан М.А., 2002).
Отже, реакція організму на лазерний вплив інтегральна і включає в себе зміни на рівні клітин, тканин та органів, тому універсальність лазеротерапії обумовлена одночасним впливом на велику кількість систем. Таким чином, під дією лазерного випромінювання відбуваютьсязміни, які реалізуються на всіх рівнях організації живої матерії:
- на субклітинномурівні: виникнення збудженихстанівмолекули, утвореннявільних радикалів, стереохімічнаперебудова молекул, збільшення швидкості синтезу білка, РНК, ДНК, прискорення синтезу колагенуі його попередників, змінакисневого балансу й активності окислювально-відновних процесів;
- на клітинному рівні: зміназаряду електричного поля клітини, змінамембранного потенціалу клітини, підвищення проліферативноїактивності і т.д.;
- на тканинному рівні: змінарнміжклітинної рідини, морфофункціональноїактивності, мікроциркуляції;
- на органному рівні: нормалізація функції якого-небудь органа;
- на системномуй організмовомурівні: виникнення відповідних комплексних адаптаційних і нервово-рефлекторних і нервово-гуморальних реакцій зактивацією симпатоадреналовоїта імунної систем.
Підсумовуючи вище сказане, можна виділити ефекти НІЛВ при дії на організм:
Пряма дія на імунний статус шляхом стимуляції імуноглобулінів і лімфоцитів (НІЛВ абсорбується реагуючими на нього хромофонами (молекулярними ензимами) (MooreK. etal., 1988; SchindlA., NeumanR., 1999; LitscherG., WangL., Wiesner-ZechmeisterG., 2000), нарощує кількість клітин-кілерів на 400-900% (WalkerJ., 1983), активує фермент флавомононуклеотид та починає продукуватися АТФ - основний носій клітинної енергії та джерело енергії усіх клітинних хімічних реакцій (ParkerJ. etal, 2000)).
Збільшення клітинної репродукції та росту, зокрема сприяння покращення засвоєння поживних речей та виведення шкідливих продукти (LitscherGetal., 2000; ParkerJ. etal., 2000) (поживні речовини неспроможні проходити скрізь ушкоджену чи ослаблену клітинну стінку, чим уповільнюється видужання (NaeserM.A., etal., 2002)). Результатом експозиції НІЛВ є швидше відновлення хрящів, сухожиль та м’язів. При цьому зменшується формування фіброзної тканини, яка слідує за пошкодженням (MarsilioAL, RodriguesJR, BorgesAB., 2003).
Стимуляція лімфо- та кровообігу, зокрема збільшення утворення капілярів у пошкодженій тканині (прискорення процесу регенерації) та акселерація ангіогенезу при тимчасовій вазодилятації (LitscherG. etal, 2000).
Вазодилятація та активація лімфатичної дренажної системи (SchindlA., NeumanR., 1999).
Нейронна блокада трансмісії болю до головного мозку. Також, завдяки редукції запалення, зменшується набряк, а значить і біль. Інший механізм блокування болю включає продукцію високих рівнів хімічних речовин, що пригнічують біль (ендорфіни та енкефаліни головного мозку та наднирникових залоз) (WalkerJ., 1983; ParkerJ. etal., 2000; NaeserM.A. etal., 2002; TuncerO., 2006).
Прискорення процесу відновлення провідності нервової клітини, збільшення амплітуди потенціалів дії, що оптимізує функціональну активність.
8. Стимуляцію тригерних та акупунктурних точок неінвазивним шляхом, чим зокрема забезпечується полегшення м’язево-скелетного болю (LitscherG, WangL, Wiesner-ZechmeisterG., 2000).
Дослідження впливу лазеротерапії на перебіг ГХ досить багаточисленні і глибоко висвітлюють динаміку показників центрального кровотоку при даній патології (Молодин В.И., Масляева Л.В., Водяницкий А.А., 2000; Мачерет Є.Л., Коркушко О.О., 2003). Зокрема, при ГХ ЛП позитивно впливає на гемодинаміку через зниження судинного тонусу, а також шляхом нормалізації міокардіальної функції серця. Під впливом ЛП знижується в крові рівень альдостерону, незалежно від типу гемодинаміки. При ГХ в основі гемодинамічного ефекту ЛП лежить феномен вибіркового зниження підвищеного периферичного опору – ефект периферійної вазодилятації, тобто ЛП ефективна при гіперкінетичній циркуляції (Молодин В.И., Масляева Л.В., Водяницкий А.А., 2000). В свою чергу, інші автори рекомендують використовувати лазеротерапію при гіпокінетичному типі кровообігу (Пеклун Н.В., Поважная С.В., Шира А.И., 2003). Також появились дані, які показують, що застосування низькоінтенсивного інфрачервоного лазерного випромінювання в режимі постійно мінливої частоти (від 10 Гц до 1500 Гц) у хворих з ГХ, незалежно від вихідного типу гемоциркуляції, викликає більше виражений гіпотензивний ефект у порівнянні з фіксованими частотними параметрами (1500 Гц), при застосуванні яких гіпотензивний ефект відзначається лише при вихідному гіперкінетичному типі (Шульц Р.Ю., 2006). В основі гіпотензивного ефекту лазеротерапії в режимі постійно мінливої частоти лежить більше виражене зниження активності пресорних гуморальних систем регуляції у вигляді зменшення рівня кортизолу, ренін-ангіотензину й альдостерону в плазмі крові в порівнянні з лазерним випромінюванням у режимі фіксованої частоти. Проведене дослідження показало виражену корекцію вегетативної дисфункції та психо-емоційних порушень, відновлення до значень фізіологічної норми показників кардіоінтервалографії й медико-психологічного тестування.
Враховуючи нормалізацію показників ССС, ці зміни можна розцінювати як підвищення функціонального резерву ССС і здатності систем регуляції адаптуватись до навантажень. Лазерна терапія дозволяє відновити системну рівновагу безболісно та неінвазивно.
При вивченні впливу лазеротерапії на кровообіг мозку у хворих з ГХ в сукупності з цереброваскулярною недостатністю спостерігається його покращення (Молодин В.И., Масляева Л.В., Водяницкий А.А., 2000; Пеклун Н.В., Поважная С.В., Шира А.И., 2003). Тому, автори рекомендують використовувати лазеротерапію в комплексному лікуванні ГХ І-ІІ стадії в сукупності з цереброваскулярною патологією. Дослідженнями встановлено сприятливий, статистично достовірний, вплив лазерного випромінювання на регрес неврологічних скарг і клінічних проявів ДЕ, функціональний стан мозкового кровообігу, біоелектричної активності ГМ по даним ЕЕГ і РЕГ (Мачерет Є.Л. і співав., 2001; 2003; Litscher G. atal., 2004).
За результатами наших досліджень, щодо впливу АП та поєднання АП і ГРТ на перебіг ГДЕ в порівнянні із застосуванням тільки медикаментозної терапії, спостерігались позитивні зміни у всіх обстежуваних групах. Однак, при порівнянні результатів терапії в групах між собою, спостерігається значно кращий результат лікування у хворих, що поряд з медикаментозною терапією отримували курс ЛП та ГРТ (Ханенко Н.В., 2003). Сумарну оцінку терапевтичної ефективності здійснювали по трибальній системі: 1 бал – без змін, скарги та результати клінічного обстеження після лікування залишаються попередніми; 2 бали – незначне покращення, відповідає зниженню або повній відсутності деяких скарг, але не більш, ніж на 50-30% від вихідного рівня; 3 бали – значне покращення, зникнення комплексу проявів захворювання на 75% від вихідного рівня.
Отже, значний позитивний ефект спостерігався у 10% пацієнтів І групи (медикаментозна терапія), а в ІІ (медикаментозна терапія + ЛП) та ІІІ (медикаментозна терапія + ЛП + ГРТ) групах відповідно, у 12,5% та 20,9%. В трьох групах спостерігалось найбільше пацієнтів з незначними позитивними результатами ефективності лікування, відповідно 56,7% пацієнтів в першій групі; 65,6% - в другій і 62,9% - в третій. Однак, процент хворих, у яких не виявлено динаміки був найбільшим серед пацієнтів І групи і складав 33,3%, у пацієнтів ІІ та ІІІ груп ці цифри значно нижчі і становлять 21,8% та 16,1%, відповідно (див.рис.8).
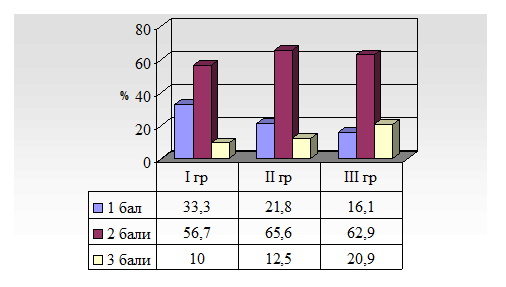
Рисунок 8. Динаміка суб’єктивної симптоматики внаслідок терапії.
Наші дослідження показали, що у хворих, в комплекс терапії яких ввійшла ГРТ, при розгляді результатів неврологічного дослідження звертає увагу зменшення частоти основних клінічних проявів, зокрема найбільш вагома позитивна динаміка таких симптомів, як болючість тригемінальних точок та симптом Манна. Наведені дані свідчать про зменшення застійних явищ в судинах головного мозку і покращення венозного відтоку під впливом ГРТ.
В літературі з’явились повідомлення про застосування ЛП на ТА (V(VII)60, 67, E(ІІІ)36, GI(ІІ)4), що веде до збільшення Vmпо СМА (за даними ТКДГ) і збільшення активності потиличних і лобних ділянок (за даними функціональної МРТ)(LitscherG, WangL, Wiesner-ZechmeisterG., 2000). А стимуляція лазерним випромінюванням точки VВ(ХІ)43 приводить до активації таламусу, червоного ядра, стовбуру і поля 40 і 22 по Бродману, в порівнянні з плацебо (Siedentopf G.M. atal., 2005), що підтверджується даними ОФЕКТ. Автори звертають увагу на те, що вплив в більшій мірі проявляється на іпсилатеральній стороні.
Ми б хотіли більш детально показати вплив комплексного лікування хворих з ГДЕ І-ІІ ст. з використанням АП і ГРТ на церебральну гемодинаміку (табл. 14). За даними УЗДГ після курсу проведеної терапії найбільш суттєві зміни були виявлені у пацієнтів третьої групи (медикаментозна терапія + ЛП + ГРТ) (рис. 9а, 9б). Зокрема, при порівняльному аналізі КА Vs до та після лікування, оскільки цей доплерографічний показник найбільш інформативний по відношенню до стану мозкового кровообігу, то достовірне зниження його (або тенденція) виявлені в судинах каротидного басейну – в ЗСА, у ВСА, а також в судинах ВББ – в ХА, що свідчить про позитивну динаміку на фоні проведеного лікування. Важливо відмітити і позитивну тенденцію зменшення КА в сифоні ВСА. Тенденція до зменшення міжпівкульової асиметрії в ЗСА, ВСА та ХА на фоні не в усіх відділах достовірно змінених значень швидкості кровотоку в однойменних артеріях може бути пояснена вирівнюванням міжпівкульових швидкісних показників в цих судинних басейнах.
Звертає на себе увагу тенденція до підвищення Vs в ЗСА з обох сторін.
Результати аналізу показників індексу RI у хворих після курсу терапії показав, що достовірне зменшення його відмічене в екстракраніальних судинах каротидного та ВББ, а точніше, в правій надблоковій артерії (НА), правій ХА та БА. Стосовно судин інтракраніального відділу каротидного басейну, то в сифоні ВСА з обох сторін спостерігається зниження RI: зліва достовірне – 0,6±0,02; 0,55±0,01, справа тенденція до зниження – 0,61±0,02; 0,58±0,03. Таким чином, після курсового лікування за допомогою медикаментозної терапії, АП та ЛП периферичний судинний опір в НА та інтракраніальних судинах каротидного і ВББ знижувався.
Після курсу терапії у хворих з ГДЕ І-ІІ ст. ІІІ групи відмічено зниження ригідності судинної стінки, переважно в тих судинах, які першочергово були з високим значенням індексу РІ, тобто в крупних судинах (дві ВСА, права НА), відмічено достовірне зниження РІ.
Аналізуючи отримані дані, можна сказати, що використання АП та ЛП на фоні медикаментозної терапії має регулюючий вплив на периферичний судинний опір, зокрема в інтракраніальних судинах, зменшує Vs та Vd в цьому ж басейні. Стосовно екстракраніальних судин, то слід відмітити зворотну дію, тобто підвищення Vs в крупних судинах.
У пацієнтів другої та першої груп (медикаментозна терапія + ЛП і тільки медикаментозна терапія) зміни в судинах головного мозку за даними УЗДГ були менш вагомі.
Після проведеного лікування відмічена позитивна динаміка по відношенню до церебрального ангіоспазму. Так, у хворих першої групи явища ангіоспазму практично зникли у 21% випадків, а в другій та третій – в 57,1% та 60,6% випадків, відповідно. У 6,7% хворих першої групи і у 20,3% пацієнтів другої групи та в 22,6% – третьої групи значно зменшились ці явища, важливо відмітити, що у цих осіб до лікування спостерігався двохсторонній ангіоспазм.
Внаслідок терапії у хворих з ознаками венозної дисциркуляції встановлено значний позитивний ефект, зокрема в першій групі у 33,3% випадків, в другій – 37,5%, в третій – 45,2%.
Таблиця 14.
Порівняльний аналіз основних гемодинамічних показників в інтракраніальних відділах каротидного басейну та В ВББ у хворих з ГДЕ до та після лікування
|
Показники |
Група хворих з ГДЕ до терапії |
І група після терапії,
|
ІІ група після терапії,
|
ІІІ група після терапії,
|
|
Vs СМА dex (см/с) |
83,9±3,8 |
82,1±3,4 |
81,2±2,5 |
81,4±2,7 |
|
Vd СМА dex (см/с) |
41,7±3,2 |
41,3±3,5 |
40,2±3,8 |
40,6±5,4 |
|
RI СМА dex |
0,52±0,02 |
0,52±0,02 |
0,51±0,02 |
0,52±0,01 |
|
PI СМА dex |
0,85±0,04 |
0,8±0,03 |
0,78±0,02 |
0,78±0,02 |
|
Vs СМА sin (см/с) |
85,5±2,3 |
86,6±2,9 |
85,4±2,5 |
85,3±4,6 |
|
Vd СМА sin (см/с) |
41,2±3,4 |
41,3±3,4 |
37,9±3,4 |
38,4±3,1 |
|
RI СМА sin |
0,52±0,02 |
0,51±0,03 |
0,52±0,01 |
0,52±0,02 |
|
PI СМА sin |
0,86±0,04 |
0,85±0,03 |
0,8±0,04 |
0,81±0,03 |
|
КА, % |
14,6±2,8 |
14,5±3,4 |
12,1±3,8 |
12,5±5,7 |
|
Vs ВСА сифон dex (см/с) |
83,2±2,3 |
81,3±2,8 |
74±3,2* |
75,4±3,1* |
|
Vd ВСА сифон dex (см/с) |
40,8±3,7 |
40,1±3,3 |
36,1±3,23 |
38,4±2,5 |
|
RI ВСА сифон dex |
0,61±0,02 |
0,62±0,03 |
0,56±0,02 |
0,58±0,03 |
|
PI ВСА сифон dex |
0,79±0,04 |
0,78±0,03 |
0,79±0,04 |
0,81±0,03 |
|
Vs ВСА сифон sin (см/с) |
86,5±4,1 |
84,2±5,1 |
77,2±2,3* |
83,3±4,2 |
|
Vd ВСА сифон sin (см/с) |
46,5±3,8 |
45,3±2,9 |
37,4±2,1* |
37,3±2,2* |
|
RI ВСА сифон sin |
0,60±0,02 |
0,59±0,03 |
0,54±0,02* |
0,55±0,01* |
|
PI ВСА сифон sin |
0,81±0,03 |
0,79±0,03 |
0,82±0,03 |
0,83±0,04 |
|
КА, % |
15,4±2,2 |
13,6±4,8 |
10,1±2,3 |
10,3±1,7 |
|
Vs ЗМА dex (см/с) |
47,1±2,8 |
45,3±3,3 |
45,9±3,6 |
45,7±3,4 |
|
Vd ЗМА dex (см/с) |
20,3±1,9 |
19,6±2,3 |
19,5±1,3 |
18,2±1,8 |
|
RI ЗМА dex |
0,58±0,03 |
0,58±0,04 |
0,58±0,01 |
0,57±0,02 |
|
PI ЗМА dex |
0,99±0,06 |
0,98±0,04 |
0,95±0,02 |
0,94±0,03 |
|
Vs ЗМА sin (см/с) |
44,3±2,8 |
43,3±2,4 |
45,1±2,3 |
47,5±3,3 |
|
Vd ЗМА sin (см/с) |
20,3±1,8 |
20,1±1,5 |
21,1±2,1 |
21,1±2,4 |
|
RI ЗМА sin |
0,54±0,02 |
0,58±0,03 |
0,55±0,04 |
0,56±0,03 |
|
PI ЗМА sin |
0,96±0,03 |
0,95±0,03 |
0,95±0,03 |
0,94±0,04 |
|
КА, % |
14,4±3,3 |
14,2±3,5 |
13,3±3,5 |
12,3±4 |
|
Vs ХА dex (см/с) |
43,2±2,7 |
41,3±2,9 |
39,8±1,5 |
40,1±1,3 |
|
Vd ХА dex (см/с) |
22,9±1,7 |
21,5±1,6 |
19,3±2,2 |
19,9±2,1 |
|
RI ХА dex |
0,58±0,02 |
0,56±0,03 |
0,53±0,02 |
0,52±0,02* |
|
PI ХА dex |
0,89±0,03 |
0,9±0,02 |
0,91±0,04 |
0,89±0,03 |
|
Vs ХА sin (см/с) |
39,7±3,5 |
38,5±2,6 |
35,4±2,4 |
36,3±4,3 |
|
Vd ХА sin (см/с) |
19,9±2,1 |
18,8±1,9 |
17,6±2,4 |
17,6±2,5 |
|
RI ХА sin |
0,55±0,02 |
0,55±0,03 |
0,52±0,02 |
0,52±0,03 |
|
PI ХА sin |
0,89±0,04 |
0,91±0,03 |
0,9±0,04 |
0,93±0,03 |
|
КА, % |
32,2±3,4 |
28,4±4,3 |
24,6±2,2 |
24,4±2,7* |
|
Vs AБ (см/с) |
61,4±3,3 |
58,3±2,6 |
55,4±2,5 |
56,2±2,9 |
|
Vd AБ (см/с) |
28,6±2,3 |
27,4±2,1 |
25,9±2,3 |
25,3±2,4 |
|
RI AБ |
0,61±0,01 |
0,59±0,02 |
0,54±0,02* |
0,54±0,03* |
|
PI AБ |
0,8±0,03 |
0,08±0,02 |
0,081±0,03 |
0,08±0,02 |
Примітка.
* достовірність результатів з даними до терапії.
Таким чином, у хворих з ГДЕ І-ІІ ст. під впливом комплексного лікування відмічено виражений регулюючий вплив на церебральну гемодинаміку як в артеріальній ланці (зменшення ангіоспазму), так і в венозній, а також спостерігалось зменшення ступеню міжпівкульової асиметрії мозкового кровотоку. При чому, у пацієнтів, що отримували поряд з традиційним лікуванням тільки ЛП нормалізуються показники, що характеризують тонус судин переважно в судинах інтракраніального відділу каротидного і ВББ. А при поєднанні вище згаданої терапії з ГРТ, ще й нормалізуються показники, що характеризують стан кровотоку в крупних екстракраніальних судинах.
На рисунках 9а та 9б зображена картина УЗДГ пацієнта ІІІ групи до та після курсу терапії.
В літературі ми можемо побачити небагато даних щодо впливу методів рефлексотерапії на біоелектричну активність ГМ (Xu M.atal., 1998). Аналіз проведеного нами лікування вище згаданих пацієнтів показав позитивні результати динамічного дослідження функціональної активності ГМ в усіх трьох групах, хоча найбільш видимі зміни були у пацієнтів ІІІ групи. Як видно з таблиці 15 при порівнянні результатів медикаментозної терапії та комплексної терапії за допомогою використання ЛП, де теж спостерігається вагома ефективність, у пацієнтів ІІІ групи знизилась кількість дезорганізованих ЕЕГ на 15% і спостерігалась у 23 % обстежених. Слід зауважити, що у пацієнтів цієї групи з’явились ЕЕГ І-го типу (2%), що характеризує значний регулюючий вплив на стан біоелектричної активності ГМ підібраної комплексної терапії, і проявляється переважанням α-активності з амплітудою в межах 25-55 мкВ. Стосовно десинхронного варіанту ЕЕГ-кривої, то вона також зменшилась 8%. ІІ-й тип ЕЕГ дещо зріс (на 19%), що вказує також на покращення електрогенезу кори ГМ, так як І-й та ІІ-й типи ЕЕГ є варіантами норми.
Біоелектрична активність головного мозку у хворих з ГДЕ І –ІІ ст. після лікування (%)
|
Тип ЕЕГ |
Дані до терапії
|
І гр. після терапії
|
ІІ гр. після терапії
|
ІІІ гр. після терапії
|
|
І |
- |
- |
- |
2 |
|
ІІ |
22 |
31 |
38 |
41 |
|
ІІІ |
42 |
39 |
37 |
34 |
|
ІV |
36 |
30 |
25 |
23 |
|
V |
- |
- |
- |
- |
Оцінюючи результати у пацієнтів І та ІІ груп, тут спостерігались ті ж тенденції до змін ЕЕГ картини, що і в ІІІ групі, за винятком появи І-го типу ЕЕГ. Так, зменшення повільної активності та дезорганізації ЕЕГ-ритму в І групі зменшилась на 6% в ІІ – на 11% і, відповідно, спостерігалась у 30% та 25% випадків. Ознак десинхронізації після проведеного лікування виявлено у 39% обстежених у І групі та в 37% в ІІ групі. Також для даних груп характерне збільшення кількості гіперсинхронних варіантів ЕЕГ, що характеризується збільшенням кількості α-хвиль, зустрічається в І групі у 31%, в ІІ – 38% випадків.
Аналіз впливу проведеного лікування на частотно-амплітудні показники основних ритмів ЕЕГ у хворих з ГДЕ І-ІІ ст. показав гетеротопність змін. Так, відмічається достовірне зниження потужності Δ-ритму переважно в лівих центральній та потиличній ділянках (20,2±1,3%; 19,9±1,9% - ІІ група; 20,7±1,5%; 19,9±1,4% – ІІІ група; до терапії – 25,7±1,8%; 24,6±1,9%), а також підвищення рівня потужності β-ритму в цих же ділянках (відповідно, 25,5±1,2%; 26,5±1,2% - ІІ група; 25,5±1,1%; 26,3±1,3% - ІІІ група; до терапії – 21,4±1,1%; 22,1±1,1%). Такі зміни характерні в основному у пацієнтів ІІ та ІІІ груп. Однак, спостерігається тенденція до зниження потужності Δ-ритму та підвищення β-ритму у пацієнтів, які проходили тільки медикаментозне лікування (20,7±2,4 та 25,3±1,5%), зокрема, в лівій скроневій ділянці.
При розгляді середнього частотного значення спостерігається також підвищення середньої частоти в лівій потиличній ділянці, яка достовірно в трьох групах не відрізнялась. При вивченні частоти α-ритму після терапії спостерігається його збільшення в усіх ділянках, але найбільш вагомий результат зареєстровано в обох центральних ділянках та лівій потиличній: відповідно, на 0,27; 0,26; 0,2 Гц – в І групі, на 0,29; 0,27; 0,23 Гц – ІІ група, 0,29; 0,29; 0,23 Гц – ІІІ група.
Таким чином, комплексна терапія здійснює регулюючий вплив на функціональні структури ГМ, що генерують Δ-ритм і мають деякий активуючий вплив на рівень біоелектричної активності кори ГМ в лівій півкулі. Однак, достовірних відмінностей між результатами спектрально-частотного аналізу ЕЕГ між групами не виявлено.
На рисунках 10а і 10б зображені фрагменти ЕЕГ пацієнтки ІІІ групи.
Рисунок 10а. Фрагмент ЕЕГ до лікування. Рисунок 10б. Фрагмент ЕЕГ після лікування.
Вивчаючи динаміку показників ХМ АТ, спостерігали достовірне зниження (р<0,01) рівня середнього АТ в усіх пацієнтів. При чому, зниження САТ було найбільш вираженим у хворих, що поряд з медикаментозною терапією отримували ГРТ і ЛП (ІІІ група) і складало 131±2,7 мм. рт. ст. ( І – 139,4±3,3 мм. рт. ст.; в ІІ – 139,3±2,3 мм. рт. ст.). ДАТ в свою чергу достовірно знизився тільки в ІІ та ІІІ групах (85,1±1,6 мм. рт. ст.; 84,7±1,8 мм. рт. ст.).
Таблиця 16.
Динаміка показників АТ та ВРС у хворих з ГДЕ І-ІІ ст.
|
Показники АТ |
Дані до терапії
|
І гр. після терапії |
ІІ гр. після терапії |
ІІІ група після терапії |
|
Добовий САТ, мм. рт. ст. |
155,7±4,9 |
139,4±3,3** |
139,3±2,4** |
131,2±2,7** |
|
Добовий ДАТ, мм. рт. ст. |
93,6±3,1 |
92,2±2,1 |
85,1±1,6* |
84,7±1,8* |
|
САТ(д), мм. рт. ст. |
159,2±4,3 |
145,1±3,2** |
144,2±2,8** |
139,3±3,3** |
|
САТ(н), мм. рт. ст. |
151,5±6,4 |
132,7±2,6** |
130,5±3,1** |
119,8±2,9** |
|
ДАТ(д), Мм. рт. ст. |
99,1±5,6 |
95,3±2,0 |
88,2±1,4 |
87,4±1,8* |
|
ДАТ(н), мм. рт. ст. |
91,6±3,5 |
87,3±1,4 |
78,3±1,5** |
77,9±2,0** |
|
Добовий індекс (систол.), % |
5,7±1,2 |
8,3±1,4 |
11,5±1,1** |
12,4±1,3** |
|
Добовий індекс (діастол.), % |
8,4±1,1 |
9,4±1,3 |
13,2±1,6* |
14,6±1,8** |
|
LF, мс2 |
704±129,8 |
621±123,2 |
595±111,3 |
589±102,7 |
|
HF, мс2 |
322±118,1 |
324±109,4 |
389±122,1 |
392±107,3 |
|
LF/HF, ум. од. |
2,18±0,26 |
2,03±0,21 |
1,5±0,23 |
1,5±0,32 |
Примітка:
* достовірність результатів у порівнянні з даними до лікування (p<0,05);
** достовірність результатів у порівнянні з даними до лікування (p<0,01).
Встановлено, що підібрана нами терапія володіє нормалізуючим впливом не тільки на середній рівень АТ, але і на добовий ритм АТ. До лікування у обстежених нами хворих середні показники добового індексу були низькими. В процесі лікування у пацієнтів ІІ та ІІІ груп відбулось більш вагоме зниження середнього нічного АТ (САТ на 13,9% - ІІ група; 20,9% - ІІІ група; ДАТ на 14,5% - ІІ група; 15% - ІІІ група) в порівнянні з середнім денним (САТ на 9,5% - ІІ група; 12,5% - ІІІ група; ДАТ на 11% - в ІІ групі, на 11,8% - ІІІ-й ), що привело до збільшення показника ступеню нічного зниження АТ. В І групі динаміка добового індексу не достовірна в порівнянні з показниками до терапії, добовий індекс САТ тут становив 8,3±1,4%, а ДАТ - 9,4±1,3% (табл.16).
Як показали дослідження найбільша динаміка ступеню нічного зниження АТ спостерігалась у пацієнтів з добовим профілем - non-dipper та night piker. У цих хворих добовий індекс як для САТ, так і для ДАТ перевищив вихідний рівень в окремих випадках у 3 рази, що було більш типовим в ІІ та ІІІ групах. У осіб, з рівнем добового індексу в межах норми, відбувалось деяке зниження цього показника.
Слід зауважити, що терапія у жодному з випадків суттєво не впливала на ЧСС.
При аналізі ВРС показник симпатовагальної рівноваги також зменшився, що пов’язано із зменшенням спектру низькочастотних коливань, які характеризують симпатичну активність та підвищенням високочастотного спектру. Для пацієнтів, що отримували тільки медикаментозну терапію було характерне зниження тільки низькочастотного спектру, а на фоні застосування методів рефлексотерапії – спостерігалось підвищення високочастотного компоненту, тобто нормалізація балансу вегетативної нервової системи.
Більш наглядно динаміку змін вегетативної регуляції серцево-судинної системи можна побачити рис. 11.
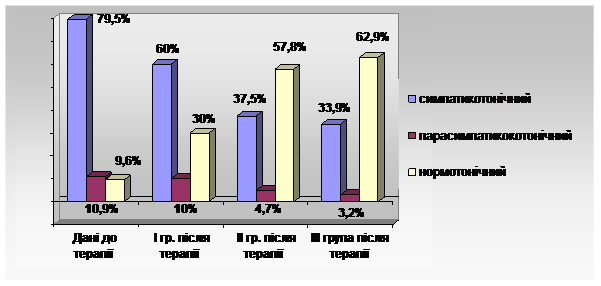
Рисунок 11. Зміни вегетативного тонусу під впливом терапії.
Як видно з наведених результатів, у пацієнтів, які приймали тільки базисну медикаментозну терапію спостерігається зменшення переважання симпатичної регуляції у порівнянні з даними до терапії тільки на 19,5%, а в цей же час у хворих, що отримували сеанси ЛП та поєднання ЛП з ГРТ частота виявлення симпатикотонії зменшилась, відповідно на 42% та 45,6%. Значно збільшилась кількість пацієнтів з нормотонічним показником вегетативної регуляції, а особливо в ІІ та ІІІ групах (відповідно, на 48,2% та 52,3%).
Слід зауважити, що у пацієнтів І групи не спостерігалось динаміки при оцінці результатів переважання парасимпатичної іннервації серцево-судинної системи, а в ІІ та ІІІ групах ці показники дещо зменшились (відповідно, 4,7%; 3,2%; до терапії – 10,9%).
Ефективність запропонованого нами методу лікування та його патогенетична суть обґрунтовані з точки зору даних електропунктурної діагностики. Після проведеного лікування повністю усунені або зменшені зсуви в системі меридіанів.
Звичайно, успіх передових методів лікування безумовно залежить від виваженого проекту клінічних досліджень, які можуть висвітлити не лише нові патофізіологічні грані, але й чітко визначити фундаментальні принципи дії тих чи інших методів терапії на людський організм. На сьогоднішній день не вистачає науково обґрунтованих рекомендацій щодо вибору режиму впливу в області популярних терапевтичних методик, зокрема лазеротерапії - пріоритетного вибору лікування, оскільки характеризується мінімальним потенційним ризиком та впливає на імунозапальні процеси, які відіграють велику роль у розвитку цереброваскулярної патології.
З метою відновлення бажаного домінування даних коливальних процесів нами було застосовано лазеротерапію із довжиною випромінюваних хвиль 890 нм у імпульсно-безперервному режимі з вихідною потужністю 4-5 мВт. Позитивний вплив лазеротерапії обумовлений задіянням імунної системи, регуляцією активностісупероксиддисмутази, утворенням АТФ, вивільненням речовин-трансмітерів та ін.(TunerJ, HodeL., 1998). Також це безпечний метод лікування (клас А за FDA) за принципом частотного резонансу у біологічних системах дозволяє стимулювати їх функціональну активність у заданих частотах.
Нами запроваджена методика лазеротерапії (Паламарчук І.С., 2007), згідно якої частоти опромінення ґрунтуються на двох основних діапазонах коливальних процесів головного мозку та серця – високо та низькочастотних, що характерно для здорових осіб (у бадьорому стані) середнього та молодого віку. Так, ß-ритм ГМ і HF спектр ритму серця знаходяться відповідно у діапазонах відносно високих частот - 14-40 Гц та 15-40 Гц^10-2,що дає основи визначити проміжну частоту опромінення 30 Гц для ЛП. У свою чергу α-ритм і LF спектр знаходяться відповідно у діапазонах відносно низьких частот - 4-15 Гц та 8-13 Гц^10-2 , а тому можна визначити проміжну частоту опромінення у 10 Гц. Зважаючи на існування також дуже низьких коливальних процесів (наприклад VLF спектр ритму серця у межах 0,3-4 Гц^10-2), ми також обрали додатковий третій діапазон, який для опромінення лазером становив 1 Гц.
Таким чином, впроваджена методика імпульсно-безперервного режиму лазеротерапії (Паламарчук І.С., 2007), при якій використовувалися основні частоти опромінення - 1, 10 та 30 Гц, а зони застосування виходять із місць розташування морфофункціональних структур вегетативної нервової системи та домінуючих областей основних ритмів головного мозку. Зауважимо, що в цих зонах знаходяться ТА, які дозволяють чіткіше визначити, а значить обмежити, область застосування НІЛВ: 1) лобні ділянки (тут же ТА – T(ХІІІ)24 і VB(ХІ) 14); 2) потилична зона (вазомоторний центр, ТА - VB(ХІ)25 і V(VII)10); 3) зони C7 – Th1 хребців (проекції ціліоспінального центру (ТА – Т(XIII)14) - симпатичної структури, яка володіє синаптичними зв’язками із ретикулярною формацією і нейронами таламуса); 4) надключична ділянка (проекція біфуркації сонної артерії – місця розташування барорецепторів, ТА – Е(III)11); 5) другий міжреберний простір зліва біля краю грудини (проекція синоатріального вузла (J(XIV)20, R(VIII)25), який інервується n. Vagus dexter, що чинить негативний хронотропний вплив); 6) проекція сонячного сплетіння, наднирників та жовчного міхура (точки J(XIV)15, 16, VB(XI)24, 25) - ренін-аніотензинова і гепатобіліарна системи, щ[о визначає нейрогуморальний фон.
Звідси другу та третю зони опромінювали із частотою 10 Гц – відновлення домінування α-ритму та стимуляція ціліоспінального центру. Перша, четверта та п’ята зони опромінювалися із частотою 40 Гц – з метою усунення патологічної повільної θ- і δ-активності, відновлення β-ритму – нормалізація функціональної активності головного мозку; для відновлення барорефлекторної чутливості та нормалізації ритму серця. Шоста зона опромінювалася 1 Гц – корегування нейрогуморального фону. Даний курс лікування зазвичай складався з 10 сеансів лазеротерапії (1 сеанс в день). Тривалість одного сеансу становила не більше 30 хвилин, лазерна експозиція на одну точку–зону знаходилася в межах 2 хвилин - терапевтичної дози, розрахованої за певною формулою, поданою в посібниках.
Показано, що після застосовування даної методики лазеротерапії у пацієнтів кращим чином (у 2,6 рази відносно хворих, які не отримували НІЛВ) відновлюється приріст LF/HF (різниця значень у горизонтальному положенні та вертикальному). Гемодинамічний аналіз активної ортостатичної проби також дозволив стверджувати, що використання лазеротерапії викликає більш виражені позитивні зміни, зокрема з боку таких показників, як ЧСС, САТ (у 1,8 разів), ДАТ (у 2,2 рази) (р<0,001).
Для пацієнтів з ГДЕ відмічалось зменшення представленості патологічних ритмів (θ і δ, %) поряд з наростанням презентації α-ритму і тенденцією згасання (нормалізації) амплітуди β-ритму безпосередньо після проведеного лікування. Зокрема, частка повільних хвиль δ-діапазонів при фоновому записуЕЕГ досліджуваних хворих зменшилася на 19%, θ - на 69% (р<0,05). При цьому дана терапевтична ефективністьсуттєво не відрізнялась від методики лікування. Поряд з цим спостерігалися також інші вагомі позитивні зміни які залежали від виду терапії - зменшення міжпівкулевої асиметрії по домінуючій амплітуді α-ритму (%) та частоти її виявлення у хворих, тенденція до відновлення домінування нормальних ритмів у фізіологічно їм притаманних ділянках головного мозку, покращення реакції α-ритму. Зокрема, лазеротерапія у поєднанні із медикаментозним лікуванням ефективніше впливала як на зменшення частоти виявлення міжпівкулевої асиметрії α-ритму у хворих з ГДЕ - приблизно в 1,6 рази. Слід відмітити, що НІЛВ також сприяло адекватнішому впливу на активність реакції α-ритму - нормалізацію реакції згасання αритму від фонових значень при відкриванні та реакцію відновлення при закриванні очей, ніж тільки медикаментозна терапія хворих. Лазеротерапія у поєднанні із медикаментозним лікуванням значно краще впливала на відновлення домінування нормальних ритмів у фізіологічно їм притаманних ділянках головного мозку: а-ритму в 1,3 рази, β-ритму – в 1,5 рази.При цьому терапія як медикаментозна, так і в поєднанні з ЛП,сприяла інтенсивнішому відновлення β-активності, ніж α.
Таким чином, використання низькоінтенсивного лазеру у поєднанні із методами рефлексотерапії досить ефективне при цереброкардіальній патології, оскільки дозволяє не лише мінімізувати фармакологічний вплив на організм, але й адекватно скорегувати запущений патологічний каскад вегетативних порушень шляхом безпосереднього впливу на біологічний електромагнітний континуум – особливий частотний розподіл біоелектричної активності ГМ та ВРС.
Контрольні питання до розділу.
Розділ 5. Немедикаментозна терапія цереброваскулярної патології.
Немедикаментозне лікування доцільно було б виділити на перших сторінках даного розділу, так як даний підхід є не менш важливим для лікування та профілактики цереброваскулярних захворювань, а деколи й основним і часто використовується, як монотерапія при зазначеній патології. Немедикаментозні лікувально-профілактичні заходи при ГДЕ включають такі пункти: здоровий спосіб життя, психотерапію, лікувальну фізкультуру, дієтотерапію, фізіотерапію, санаторно-курортне лікування.
Здоровий спосіб життямає важливе значення в тактиці лікувально-профілактичної роботи. Він включає правильну організацію режиму праці, відпочинку і харчування, виключення зловживання алкоголем та палінням. Паління – один із важливих факторів розвитку цереброваскулярної патології. Ураження судинної стінки токсичними продуктами тютюнового диму (нікотин, смоли, оксид вуглецю) сприяє зниженню її атромбогенного потенціалу, утворення на ній атеросклеротичних бляшок, збільшенню симпатичного тонусу і схильності артерій до спазму. Нікотин також збільшує агрегаційну активність тромбоцитів. Доведено, що відмова від паління знижує ризик розвитку цереброваскулярних захворювань.
Також хворі з початковими стадіями ДЕ нерідко декомпенсуються при напруженій розумовій праці і важкій фізичній роботі. Пацієнтам з ДЕ протипоказана робота з професійними шкідливостями: вібрацією, в гарячих та шумних цехах, з нічними змінами. До загострення захворювання часто ведуть психоемоційні перенавантаження, конфлікти на роботі та в побуті.
Психотерапія, як патогенетичний метод лікування, включає в себе певні напрямки: вироблення у пацієнта правильного і спокійного відношення до свого захворювання, психологічна адаптація до оточуючого середовища, підвищення соціальної і психологічної адаптації хворих. Рекомендується проводити психотерапію поетапно. При встановленні діагнозу проводиться роз’яснювальна психотерапія, яка полягає в основному в створенні позитивної установки відносно лікування в цілому. Завдяки такому підходу добиваються правильного уявлення про захворювання та лікувальні перспективи, а також потенціюють вплив медикаментозного лікування. В подальшому рекомендують гіпносугетивну психотерапію, в цьому випадку дезактуалізується невротична симптоматика, яка супроводжує вегетосудинну дисфункцію. Після цього проводять декілька сеансів пролонгованого навіяного сну. Цим вдається відрегулювати психоемоційний стан пацієнта, сон, нормалізувати АТ. Наступним етапом доцільно проведення сімейної психотерапії. Членам сім’ї роз’яснюють особливості хвороби, психологію пацієнта і способи спілкування з ним.
Лікувальна фізична культурапо своєму призначенню широке поняття: це не тільки лікувальна, але і профілактичнатареабілітаційнафізкультура.Лікувальна фізкультура є активним методом загальної патогенетичної і профілактичної терапії, яка позитивно впливає на рівень АТ, серцеву діяльність та мозкову гемодинаміку, сприяє відновленню їх компенсаторних механізмів, підвищує Програма лікувальної фізкультури підбирається індивідуально, проводять регулярно з поступовим збільшенням навантаження, з використанням різних форм і засобів. Частота занять повинна бути 4-5 раз в тиждень. Інтенсивність вправ вираховують виходячи з максимальної ЧСС (від 220 віднімають вік хворого в роках). Якщо хворий веде сидячий спосіб життя, то вибирають таку інтенсивність фізичних вправ, при якій ЧСС складає 60-75% від максимальної. Отже, хворим з ГДЕ особливо на ранніх етапах захворювання рекомендують поступове підвищення фізичної активності: займатися ранковою гімнастикою, здійснювати щоденні піші прогулянки (в вихідні дні – піші прогулянки в ліс, фізичну працездатність, зменшує клінічні прояви захворювання й покращує якість життя. в зимовий період – лижні прогулянки), корисно також відвідувати басейн.
Проводять заняття з лікувальної фізкультури, дотримуючись основних правил:
1) системність і послідовність впливу вправ, включаючи послідовний розподіл навантаження на різні м’язові групи;
2) поступовість у підвищенні і зниженні навантажень;
3) поступове збільшення тривалості навантажень (спочатку - 10-15 хвилин, потім - до 40 хвилин);
4) регулярність тренувань;
5) наростання дози вправ протягом процедури і курсу (з максимумом навантаження в середині процедури) з повторенням кожної вправи 4-6 разів.
Останнім часом при цереброваскулярній патології стали популярними методи релаксації. Дихальні вправи (черевним пресом) є однією з методик релаксації. Вони знижують збудження симпатичної нервової системи, знижують больові відчуття та АТ.
Методика: глибокий вдих чиниться черевним пресом та грудною кліткою в напівзігнутому або прямому положенні тіла. Поклавши руку поверх черевної порожнини під час вдиху на три рахунки, пацієнт повинен відчути, як живіт стає плоским у момент видиху на рахунок три. Ефективно починати релаксацію з 10 повільних глибоких вдихів. Якщо дихання занадто швидке, може відмічатись запаморочення, тому слід дихати повільно. Дихальні вправи потрібно виконувати в поєднанні з іншими способами розслаблення.
Техніка поступового розслаблення м’язів заснована на їх послідовному скороченні і розслабленні, починаючи з ніг і „просуваючись” далі, до стегон, сідниць, торса, рук, китиць, грудей, шиї, закінчуючи м’язами обличчя. Вправи повинні виконуватися обережно.
Потрібно не перенапружувати м’язи під час вправ і пам’ятати, що в нетренованих м’язах можуть виникнути судоми на початку освоювання техніки. Цей вид вправ — гарний спосіб познайомитися з власним організмом, так як ми часто забуваємо про м’язи, які нам потрібні для нормальних рухів. Завжди слід завершувати процедуру глибокими вдихами, що сприяє розслабленню.
Харчування при судинній патології головного мозку. Загальновідомо, що поряд з іншими важливими факторами ризику розвитку інсульту є надлишкова маса тіла й неправильне харчування. Аліментарний фактор грає значну роль в розвитку судинної патології ГМ. Порушене харчування у вигляді надлишкового прийому солі, цукру, жирів, прийом їжі із недостатнім вмістом вітамінів-антиоксидантів сприяє розвитку АГ та атеросклерозу.
Лікувальне харчування – це метод лікування харчуванням, який відповідає змінам і стану органів, процесам обміну, які порушились при захворюванні. Цього можна досягти шляхом призначення харчового раціону певного хімічного складу і енергомісткості, підбором відповідного асортименту продуктів, вибором прийомів кулінарної обробки та режимів харчування.
Лікувальне харчування при цереброваскулярній патології є важливим та ефективним методом комплексної терапії і складається із врахуванням патогенетичних механізмів окремих захворювань, які ведуть до порушення мозкового кровотоку і спрямоване на корекцію метаболічних порушень, максимальне розвантаження ССС, потенціювання дії лікарських препаратів та попередження їх негативного впливу. При призначенні лікувального харчування необхідно враховувати стадію захворювання, ступінь вираженості порушень кровообігу, стану травлення, наявності супутніх захворювань і ускладнень.
Згідно сучасних поглядів, в основі ГХ лежить перенавантаження ЦНС (кори ГМ) з утворенням осередків застійного збудження. Збудження розповсюджується на судинорухові центри і через симпатичну частину вегетативної нервової системи викликає генералізоване підвищення тонусу дрібних судин, яке підтримується ендокринно-гуморальними факторами. ГХ зазвичай супроводжується порушенням холестеринового обміну і нерідко поєднується з атеросклерозом.
Енергетична цінність дієти повинна відповідати енергозатратам організму з деяким обмеженням при розвитку атеросклерозу і особливо при наявності ожиріння.
Кількість жирів дещо зменшують (65-75 г) в основному за рахунок жирів тваринного походження, які частково заміняють рослинними жирами. Деяке обмеження жиру в раціоні доцільне не тільки в зв’язку з наявністю супутнього атеросклерозу, але і з метою пригнічення збуджуючих процесів в корі ГМ, так як наявність в їжі жирних кислот веде до порушення збуджуючих процесів.
Наявність атеросклерозу при ГДЕ визначає необхідність включити до раціону продукти, багаті ліпотропними речовинами (кисло-молочний сир).
Кількість білка в раціоні при ДЕ, яка виникає на фоні АГ повинна відповідати нормам потреби здорової людини (80-100 г). Необхідно пам’ятати про достатній вміст в раціоні повноцінних білків. Недостатність білка в їжі знижує стійкість організму до стресорних ситуацій. Лише при тривалому перебігу захворювання з ураженням нирок, що супроводжується порушенням видільної функції нирок і затримкою азотистих шлаків в організмі, кількість білків в дієті підлягає обмеженню.
Вміст вуглеводів в раціоні не обмежується. Однак, необхідно зменшувати вживання легкозасвоюваних вуглеводів при відповідному збільшенні продуктів багатих рослинною клітковиною. Обмеження легкозасвоюваних вуглеводів зумовлено в основному скритою функціональною недостатністю інсулярного апарату, наявністю гіперхолестеринемії і розвитком атеросклерозу. Доцільність введення рослинної клітковини визначається тим, що сприяє виведенню холестерину з калом і дозволяє при супутньому ожирінні зменшити енергетичну цінність раціону із збереженням почуття насичення. Вживання овочів, фруктів та ягід, багатих на калій, магній, вітаміни, відповідає головному спрямуванню лікувального харчування при АГ.
Також необхідно обмежити вживання кухонної солі, що пов’язано із підвищенням мінералокортикоїдної функції наднирників у хворих з ГДЕ, і веде до затримки натрію, і, відповідно, й рідини в організмі. Всі ці зміни сприяють підтримці АГ. Обмеження вживання солі в дієті до 4-6 г на добу сприяє зниженню збудливості ЦНС. При тяжкому перебігу і стійкій АГ рекомендована безсольова дієта, яка забезпечує підвищення діурезу і зменшення об’єму плазми крові. Крім цього, обмеження солі може сприяти підвищенню активності ліпопротеїнової ліпази і вести до зниження вмісту холестерину в крові. Але повне виключення солі на тривалий час не рекомендується, так як гіпохлоремія може сприяти накопиченню азотистих шлаків в крові. Тому при ускладненні захворювання нефроангіосклерозом із затримкою азотистих шлаків і наявністю компенсаторної поліурії, коли натрій в надлишку виводиться з організму не можна значно знижувати кількість солі в дієті. Також кількість рідини не варто обмежувати, якщо немає недостатності кровообігу.
Дієту при цереброваскулярній патології необхідно збагачувати вітамінами, які підтримують життєво важливі функції організму. Так ніацин (вітамін РР) розширює судини, має депресорну дію, підвищує нирковий кровотік, покращує мозковий кровообіг і коронарний. Ніацин міститься в печінці, м’ясі, крупах. Рибофлавін (вітамін В2) та ніацин необхідні для тканинного дихання і синтезу АТФ. Рибофлавін сприяє інактивації катехоламінів, які мають пресорний ефект, міститься в печінці, яйцях, рибі, хлібі. В свою чергу піридоксин (вітамін В6) необхідний для трансформації лінолевої кислоти в арахідонову, стимулює ліпотропну функцію холіна і виведення холестерину із організму. Біофлавоніди зменшують проникливість судинної стінки і покращують гемодинаміку в дрібних судинах.
Доцільне обмеження вживання кальциферолів, які сприяють розвитку атеросклерозу, та філохінонів, так як вони підвищують коагуляційні властивості крові.
Дієту рекомендовано збагачувати іонами калію, магнію, йоду. Калій є фізіологічним антагоністом натрію, підсилює натрійурез і має безпосередню депресорну дію на стінки судин. Він сприяє підсиленню скорочувальної функції міокарду, що особливо показано при супутній серцевій недостатності. Необхідність збагачення раціону солями калію пов’язана ще з тим, що при гіпонатрієвій дієті калій швидко виводиться з організму. Для збагачення дієти калієм необхідно вживати курагу, горіхи, мандарини, капусту, чорну смородину, молоко, сир. Магній підсилює тормозні ефекти в корі ГМ, зменшує спазм гладких м’язів судин і тим самим зменшує тиск. Іони магнію мають також гіпохолестеринемічну дію. Джерелом магнію є квасоля, горіх, печінка, чай, гречка. Доцільність збагачення дієти йодом обумовлена його протиатеросклеротичною дією. Багатими на йод є морепродукти, хліб, молоко.
Обмежується вживання продуктів, які впливають на коагуляційні властивості крові (вершки, сметана, вершкове масло та ін.), багатих біогенними амінами (сири, солена риба, боби, банани, помідори, ананаси). Підлягають виключенню із раціону продукти, що збуджують ЦНС і діяльність серця (м’ясні та рибні бульйони, міцний чай, кава, какао, шоколад, алкоголь) і подразнюють нирки (гострі закуски, приправи, копченості).
При супутньому судомному синдромі у пацієнтів з ГДЕ необхідно пам’ятати, що надлишок рідини підвищує судомну готовність, в зв’язку з чим необхідно обмежити прийом рідини до 800-1000 мл на добу, особливо зменшити об’єм одноразового прийому. В зв’язку із здатністю натрію затримувати воду в організмі, необхідно обмежити вживання харчової солі. Категорично заборонено приймати алкоголь, гострі блюда, соління, чай, каву. Їжа багата вуглеводами із невеликою кількістю білків підвищує судомну готовність, тому в раціоні збільшують кількість продуктів багатих на білки, особливо молочних з високим вмістом метіоніну, так як його недостатність веде до появи судом.
Надлишкова маса тіла також прогностично несприятливий фактор у пацієнтів даної категорії. Для визначення маси тіла використовують індекс Кетле: вага (в кг) ділять на подвоєну довжину тіла в метрах. Якщо індекс становить 25 і менше, то це вважається нормою, 25 і до 30 – надлишкова вага, більше 30 – ожиріння. Для зниження маси тіла основне значення має малокалорійне харчування і підвищена фізична активність. Рекомендується зниження загальної добової калорійності до 2200-2500 ккал і повна відмова від легкозасвоюваних вуглеводів (білий хліб, цукор, кондитерські вироби), обмеження вживання тваринних жирів (вершкове масло, жирні сорти сиру, м’яса, риби), завдяки чому можна досягти зниження маси тіла на 0,5-1 кг в тиждень.
Необхідно строго дотримуватись режиму харчування, харчування повинно бути дробовим 4-5 разів на добу з останнім прийомом їжі за 2-3 год до сну. На фоні основної дієти доцільно, особливо при ожирінні і недостатності кровообігу, періодичні 1-2 рази в 7-10 днів призначати розвантажувальні дні (яблучні, салатні, сирні та ін.). Розвантажувальні дні (яблучні) особливо показані при гіпертонічних кризах.
При вираженій АГ можна на короткий термін (3-4 дні) рекомендувати дієту Кемпнера або рисово-компотну, яка складається з рисової каші звареної на воді без солі і компоту, який дають 6 разів на день по 1 склянці і двічі в день вживають кашу.
Хворим з порушеним ліпідним обміном, перш за все з гіперхолестеринемією, пропонують всі вище перераховані дієтичні заходи, але ще з більшим обмеженням тваринних жирів і продуктів, що містять багато холестерину (печінка, яйця, жирні сорти м’яса). Згідно з рекомендацій ВООЗ, якщо протягом 6 місяців суворого дотримання дієти не вдалось нормалізувати рівень ліпідів крові, то необхідно починати медикаментозне лікування препаратами гіпохолестеринемічної дії. Найбільш ефективними є статини, які дозволяють:
Нище наводимо приклади дієт (Ильина С.И., 2005) прийнятних для хворих з ГДЕ.
Магнієва дієта.
Використовується при ГХ, що поєднується з розладами з боку жовчного міхура і печінки (затримка жовчі в жовчному міхурі, печінці й жовчних шляхах) на стадії загострення і супроводжується хронічним запором і надлишковою масою тіла. Особам, які перенесли інфаркт міокарду, цю дієту добре повторювати через 2 місяці.
1-й день
1-й сніданок - гречана каша, 200 г. Відвар шипшини, 1 склянка.
2-й сніданок - терта морква, 150-200 г, з олією.
1-й обід - пісний червоний борщ, одна порція.
2-й обід - каша пшенична із чорносливом і калиною, 200 г.
Полуденок - відвар шипшини, 2/3 склянки.
Вечеря - сир, 150 г, бажано додати кріп.
На ніч - 1/2 склянки відвару шипшини.
2-й день
1-й сніданок - каша з «Геркулеса», додати кілька пластинок дрібно порізаних сухих яблук, 200 г.
2-й сніданок - 50-70 г чорносливу розмочити в 1 склянці води або з’їсти 250 г свіжих слив.
1-й обід - капусняк, овочевий суп, не на м’ясному бульйоні, пасерувати на рослинному маслі цибулю, моркву, корінь петрушки.
2-й обід - тушкований буряк з морквою й цибулею, 200 г.
Полуденок - салат зі свіжих яблук і морської капусти, цибуля, зелень, 150-200 г.
Вечеря - сир, 200 г. На ніч - сік з моркви або 1/2 склянки відвару шипшини.
3-й день
1-й сніданок - терта морква, 200 г, з горіхами й рослинним маслом.
2-й сніданок - пшенична каша із чорносливом або розм’якшеними сухими яблуками, калиною, 200 г.
1-й обід - суп з «Геркулесом» і овочами, пісний, багато зелені.
2-й обід - капустяні котлети, 2-3 штуки
Полуденок - 2-3 печених яблука або 1 склянка із сухофруктів.
Вечеря - сир, 150 г, з однією тертою морквою
Повторювати два-три рази в рік (літо, осінь, зима).
Калієва дієта.
Використовують при ГХ з недостатністю кровообігу.
1-й день
1-й сніданок - 1-2 печені картоплини. Картоплю ретельно миють, обсушують, змазують рослинним маслом і запікають у духовці.Їдять зі шкіркою.
2-й сніданок - сік зі свіжої капусти, у нього можна додати сік моркви і яблук, 1 склянка.
1-й обід - суп-пюре з картоплі; цибуля, морква, корінь петрушки й селери пасерувати на рослинному маслі.
2-й обід – морквяне пюре, 150-200 г, із зеленню й рослинним маслом.
Полуденок - відвар шипшини, 1/2 склянки.
Вечеря - ікра з буряка, 200 г (морква, цибуля).
2-й день
1-й сніданок - спекти 1-2 картоплини й 5-7 г сала до кожної картоплини.
2-й сніданок - пшенична каша, 200 г, додати до неї кріп.
1-й обід - суп із зеленим горошком або горохом, багато кропу, картопля, морква, цибуля.
2-й обід - фруктовий або овочевий плов; рис, морква, цибуля, чорнослив, ізюм, сухофрукти.
Полуденок - відвар шипшини або компот із сухофруктів, 100 г.
Вечеря - капустяні котлети, 2-3 штуки.
3-й день
1-й сніданок - відварений буряк, 200 г, рослинне масло, 3-5 штук волоських горіхів.
2-й сніданок - спекти 2 картоплини й 5-7 г сала докожної картоплини.
1-й обід - суп вегетаріанський, можна з будь-якою крупою.
2-й обід - котлети бурякові, морквяні, гарбузові, 2- 3 штуки.
Полуденок - 2-3 яблука, краще спекти їх до м’якості.
Вечеря - відварена риба, 50-60 г, або м’ясо відварене, 40-50г, картопляне пюре, 200 г, багато кропу.
На ніч - кефір, 1/2 склянки, кисле молоко, 100 г.
4-й день
1-й сніданок - салат зі свіжих овочів або вінегрет,200 г.
2-й сніданок - розпарені сухофрукти, 50-70 г.
1-й обід - суп картопляний; цибуля, морква, додати кріп, петрушку, селеру.
2-й обід - плов овочевий: рис, морква, цибуля, корінь петрушки й селери, рослинне масло, 200 г.
Полуденок - компот, кисіль, 1 склянка.
Вечеря - гречана каша, 200 г.
Після 4 днів цієї дієти можна перейти на дванадцятиденну дієту.При лікуванні запропонованими дієтами потрібно обмежити вживання хліба до 70-100 г на день, відмовитися повністю від вершкового масла, жирних сортів риби й м’яса, копченостей, консервів, м’ясних і рибних бульйонів.Із пшоняної, пшеничної, гречаної й вівсяної крупи можна робити не тільки рідкі каші, але й котлети, оладки, биточки, запіканки, пудинги.
В профілактиці та лікуванні ГДЕ широко використовується фізіотерапія: електрофорез лікарських препаратів, електросон, бальнеотерапія (загальні, радонові, сульфідні, йодобромні, вуглекислі, кисневі, хвойні, азотні ванни на прісній або морській воді), магнітотерапія, оксигенотерапія (кисневі коктейлі) та ін..
Однією із основних ланок лікувально-профілактичної допомоги пацієнтам з даним захворюванням є санаторно-курортне лікування, яке показане при початкових стадіях захворювання. Необхідно враховувати, що багато пацієнтів з вище вказаною нозологією погано переносять перебування на південних курортах в жаркий період року та в високогірних районах, де часті переміни метеорологічних умов. Таких хворих доцільніше направляти в місцеві санаторії серцево-судинного типу, де немає необхідності тратити час на акліматизацію. Хворі, які перенесли минуще порушення мозкового кровообігу, або легкий інсульт, можуть бути направлені на санаторно-курортне лікування не раніше, ніж через 3-4 місяці після гострого періоду. Санаторно-курортне лікування показане при АГ І-ІІ ст. доброякісного перебігу без частих гіпертензивних кризів, без прогностично несприятливих порушень ритму і провідності, при серцевій недостатності не вищій від І ст..
Обсяг лікувальних заходів санаторно-курортного лікування:
Санаторний режим: І-ІІ.
Дієта:10 або 15 (раціон № 4 або № 5).
Кліматотерапія: прогулянки по території санаторію, повітряні, сонячні ванни, інше.
Руховий режим:лікувальна фізкультура, ранкова гігієнічна гімнастика (індивідуальна), лікувальна гімнастика (групова, індивідуальна), велотренування, прогулянки.
Бальнеотерапія: загальні або 4-камерні „сухі” вуглекислі або вуглекислі, або радонові, або йодобромні, або кисневі, або скипидарні з білою емульсією, або радоново-скипидарні, або сірководневі, або хлоридно-натрієві, або хвойні, або інші ванни; лікувальні душі: циркулярний або підводний душ-масаж.
Апаратна фізіотерапія: гальванічний комір за Щербаком, або електрофорез комірцевої зони (2 % розчин папаверину гідрохлориду, або 5 % розчин новокаїну, або 3 % розчин броміду натрію, або ін.), або загальний електрофорез за Вермелем (1 % розчин аспірину, або 1 % розчин нікотинової кислоти), або транскардіальний електрофорез (5 % розчин новокаїну або 1 % розчин нікотинової кислоти), або електрофорез брому, або аміназину, або платифіліну, або магнію, або еуфіліну, або но-шпи, або папаверину, або обзидану, або тканинних препаратів, або гангліоблокаторів, синусоїдальна модульована, або дециметровохвильова, або короткохвильової частоти терапія на зону сегментарної іннервації серця, або на передсерцеву зону, або на литкові м’язи, або магнітотерапія на зони сегментарної іннервації серця.
Додатково:
Термін санаторно-курортного лікування: 18-21-24 дні.
Показники результатів лікування: підвищення толерантності до фізичних навантажень, перехід на другий руховий режим, поліпшення даних інструментальних та функціональних досліджень, зменшення частоти й дози прийому антигіпертензивних препаратів, зменшення факторів ризику і метеопатичних реакцій, поліпшення загального самопочуття.
До переліку немедикаментозних напрямків лікування хворих з ГДЕ можна віднести тренування пам’яті. Вище згадувалось про когнітивні порушення, зокрема, розлади пам’яті, як один з основних симптомів при ДЕ. Тому для покращення пам’яті важливо викликати її передумови (Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В., 2006). З цією метою можна використовувати три наступних напрямки: 1) навчання методу, що сприяє реєстрації інформації, позвитку уваги та спостережливості; 2) навчання методу, який полегшує закріплення, утримування і згадування зареєстрованої інформації. В основі цього методу лежить або ефект повторення, як найбільш простий, або розвиток здатності організувати запам’ятовування з допомогою певних асоціацій, уявлення, вольового зусилля, які можливі при збереженні інтелекту; 3) вироблення переносу навчання в штучних умовах на реальні життєві ситуації.
При проведенні таких занять необхідно чітко дотримуватись принципу поступовості при ускладненні завдань – від простого при повторенні до складного. Потрібно уникати перевтомлювання від занять, вони повинні бути частими, але короткими – близько 45 хвилин в день. Рекомендується створення атмосфери гри, що дозволяє досягти зацікавленості, покращує мотивацію.
Тренування пам’яті хворого проводиться з врахуванням особливостей його особистості, інтелектуального багажу і порушення пам’яті, при обов’язковій відсутності негативної установки на проведення занять. Лікар або родич, який проводить заняття, активно співпрацює з хворим, обов’язковою умовою для проведення занять є тихе окреме приміщення. Курс занять по тренуванню пам’яті необхідно поєднувати з медикаментозним лікуванням і продовжувати в середньому 2 місяці.
Нижче наведені варіанти занять по тренуванню пам’яті.
Завдання 1.Лікар бере в руку набір предметів (бажано яскравих та великих), наприклад – ключ, ґудзик, ручка і т.д. Показують предмети хворому, а потім, сховавши їх, просять пацієнта написати назву предмета і описати його. Періодично змінюють предмети та збільшують їх кількість (від 4 до 10).
Завдання 2.Лікар ставить на стіл 7 яскравих і великих предметів, накриває платком, далі показує їх хворому на короткий час, потім знову накриває їх платком. Лікар просить пацієнта записати предмети і описати їх. Число предметів можна збільшити до 10.
Завдання 3.Лікар, що проводить заняття, просить пацієнта записати словесний портрет лікуючого лікаря (очі, ніс, підборіддя і т.д.).
Завдання 4.Просять хворого описати обстановку його кімнати вдома (меблі, відеотехніка і т.д.).
Завдання 5.Хворому читають уголос незнайомий, але доступний для сприйняття вірш по строфам, далі просять в 1-й день відтворити 1-у строфу; 2-й день - повторити 1-у строфу і вступ 2-ї; 3-й день – повторити 1-у і 2-у строфи і вступ 3-ї і т.д.
Завдання 6.Уявна прогулянка по центральній вулиці міста. Хворий повинен розказати і по можливості описати (фактично згадати) визначні місця, зовнішній вигляд окремих будинків і т.д.
Завдання 7.Уявний магазин. Хворий отримує завдання „купити” продукти для приготування обіду. Періодично „меню” міняють.
Завдання 8.Пацієнту рекомендують записувати в щоденник події минулого дня.
Досить часто, завдяки таким чи іншим вправам, вдається досягти значних успіхів у тренуванні пам’яті. Варто підкреслити, що хворі похилого віку надають перевагу медикаментозному лікуванню когнітивних порушень, тому роз’яснення даної методики, її переваги над ліками, поступове включення ігрового підходу до проведення занять, а також позитивний вплив при групових заняттях, можуть змінити скептичне ставлення пацієнта до таких вправ.
Окремої уваги заслуговує такий розділ в терапії хворих з ГДЕ, як фітотерапія, використання методів народної терапії. Виходячи з власного досвіду, дуже часто пацієнти звертаються з проханням призначити фітопрепарати, дати пораду. Однак, нам часто не вистачає таких знань. А от наші предки набагато краще за нас знали навколишній рослинний світ, добре розумілися на лікарських властивостях рослин, уміли їх збирати, заготовляти, лікуватися ними. Людина буде здоровішою, зробить своє життя щасливішим, якщо кожного дня буде споживати те, що дарує їй природа(Ильина С.И., 2005). Ось деякі рекомендації для зниження АТ.
ОБЛІПІХА. Використовують ягоди як засіб, що стабілізує тиск. Вони знижують підвищений тиск і підвищують знижений. Ягоди додають у чай і в овочеві салати.
Добре знижує тиск ТОМАТНИЙ СІК, але без солі.
Відвар квіток і плоди КАЛИНИ ЗВИЧАЙНОЇ м’яко знижують АТ: 1 столову ложку квіток або 20—25 ягід заливають 1 склянкою окропу. П’ють по кілька ковтків протягом дня в проміжках між прийомами їжі.
Сік КАРТОПЛІ має гіпотензивну властивість. Рекомендують змішувати сік картоплі з буряковим соком, що містить бетанін і має судиннорозширюючий ефект у рівних частинах (1:1); п’ють по 1/4 склянки ранком натще, вдень за 20 хвилин до їжі, а також на ніч.
Квітки, листки, плоди МАЛИНИ ЗВИЧАЙНОЇ:дуже добре допомагає відвар при атеросклерозі в поєднанні з ГХ. Улітку потрібно побільше ягід малини, а на зиму насушити квіток і листків.Малина добре піддається сушінню. 1 столову ложку сухих ягід і листків заливають 1 склянкою окропу. П’ють по 1/4 склянки протягом дня через 20-30 хвилин після їжі.
ГХ I-II стадії добре лікувати ЧОРНОПЛІДНОЮ ГОРОБИНОЮ. Роблять настойку, компот. Ягоди можна додавати в салат, вінегрет.
Не можна забувати про ЧОРНОСЛИВв лікуванні ГХ, особливо якщо є набряки. Чорнослив можна додавати в салати, вінегрет, каші, запіканки, сир.
Знижує АТ настій із квіток і листків БАРВІНКУ МАЛОГО: 5 г сировини заливають 1 склянкоюокропу. П’ють по 1 чайній ложці 6-8 разів у день через 20-30 хвилин після їжі.
Надземну частину МАТЕРИНКИ ЗВИЧАЙНОЇ зриваютьна початку цвітіння (липень-серпень), висушують. Настій готують із 1 столової ложки сухої материнки й 2 склянок окропу.Настоюють до охолодження. П’ють по l/3 склянки 5-7 разів у день, бажано після їжі.
КОРИЦЯ добре знижує тиск, тому її необхідновикористовувати у всіх блюдах, в яких використовуютьцукор, виключивши останній.
КАЛЕНДУЛА ЛІКАРСЬКА знижує САТ, поліпшує серцевий ритм, підсилюєроботу серця. Молоді соковиті листки календули можна додавати в салати.Зберігають листки, загорнувши у фольгу й поклавши в морозильник.Їх не можна розморожувати, так як при цьому втрачається лікувальний ефект. Календула має омоложуючі властивості, це один з «молодильних» засобів.На Сході в усі салати й м’ясні блюда додають календулу.У Болгарії з календули виготовлений спеціальний лікувальний препарат для тих, кому за тридцять.Лікувальний ефект календули проявляється, якщо використовувати настій (1 частина квіток, 10 частин води).Його можна додавати в чай. Він добре поєднується із соком калини й медом: 1 склянка води, 1 склянка соку калини, 7-8 столових ложок календули, l/З склянки меду.Вживають напій у співвідношенні 1 частина суміші й 10 частин води.
Здавна на Русі користувався популярністю БУРЯКОВИЙ КВАС. Він, як і маринований буряк, добре знижує АТ.
МОРСЬКА КАПУСТАмістить стеарини, які запобігають жировій інфільтрації коронарних і печінкових судин, у результаті чого знижується АТ за рахунок розширення периферичних судин.
Висушені хвостики від КАВУНА ЗВИЧАЙНОГО попередньо подрібнюють. 1 столову ложку сировини заливають 1 склянкою окропу, варять 10 хвилин на дуже маленькому вогні. П’ють по 1/4 склянки 3-4 рази в день через 30 хвилин після їжі.
Насіння КРОПУ (ГХ, стенокардія, хронічна коронарна недостатність, безсоння): 1 чайну ложку насіння заливають 2 склянками води, доводять до кипіння, настоюють, поки не охолоне, проціджують. П’ють по 1/3 склянки 5-6 разів у день за 20 хвилин до їжі.
Суміш: корінь ВАЛЕРІАНИ ЛІКАРСЬКОЇ, квітки й плоди ГЛОДУ, ДЕРЕВІЙ ЗВИЧАЙНИЙ, корінь ЛЕПЕХИ БОЛОТНОЇ, БАРВІНОК — усе в рівних кількостях. Можна суміш готовити з 4 трав, вони всі взаємозамінні; 1 столову ложку суміші заливають 2 склянками окропу, настоюють під кришкою всю ніч. Ранком підігрівають, проціджують. П’ють по 1 склянці 2 рази в день за 15-20 хв до їжі.
Ягоди, листки, кора, коріння БАРБАРИСУ ЗВИЧАЙНОГО містять алкалоїд берберин, який добре знижує АТ. 1 столову ложку сировини (сухого, свіжого) заливають 2 склянками окропу, настоюють приблизно 30 хвилин, проціджують. П’ють по 1/3-1/2 склянки 2-3 рази в день у проміжках між їжею. Зберігають у холодильнику.
Серед сирих соків особливо цінний ЦИТРУСОВИЙ і з ЧОРНОЇ СМОРОДИНИ, які містять, крім вітаміну C, також велику кількість Р-фактора, що зміцнює судини і робить їх непроникними.
Німецька народна медицина радить пити в день по 1-2 склянки холодного настою ДЕРЕВІЮ ЗВИЧАЙНОГО. П’ють маленькими ковтками протягом дня. Настій: 1 столову ложку листків і квіток деревію заливають 1-2 склянками окропу, перед прийомом проціджують.
Квітки БІЛОЇ АКАЦІЇ, заварені як чай, здатні знижувати АТ, створюючи на організм людини вплив, близький до впливу резерпіну. Доза індивідуальна.
Одну столову ложку натертого ЛИМОНА йЖУРАВЛИНИ, 1/2 чайної ложки свіжозмеленої на кавомолці ШИПШИНИ КОРИЧНЕВОЇ, 1 склянка МЕДУ. Усе змішують. Приймають по 1 столовій ложці ранком і ввечері при атеросклерозі судин ГМ, при всіх захворюваннях ССС.
Одну склянку соку білої РІПЧАСТОЇ ЦИБУЛІ і 1 склянку ТРАВНЕВОГО МЕДУ перемішують. В отриману суміш додають 50 г пропущеної через м’ясорубку шкірки ЛИМОНА ЗВИЧАЙНОГО. Зберігають у холодному місці, щільно закривши. Приймають по 1 чайній ложці 3 рази в день за 1 годину до їжі або через 2-3 години після прийому їжі. Курс лікування - 2 місяці. Цей засіб корисний і при атеросклерозі судин ГМ.
ПОМІДОРИ ЇСТІВНІможна використовувати для профілактики ГХ. Помідори обдають окропом, очищають від шкірочки. Ріжуть на дрібні шматочки, додають небагато цукру, дещо охолоджують. Приймають по 1-2 столові ложки кілька разів у день.
ОГІРКИ ПОСІВНІм’яко знижують невисокий АТ, добре допомагають при початкових формах ГХ, знижують рівень холестерину в крові.
При ГХ рекомендовано щодня випивати по 1/4 склянки МОРКВЯНОГО СОКУ 1 раз у день. Через 1 місяць прийому на 1 місяць зробити перерву.
Народні цілителі радять вживати у великій кількості ПАСТЕРНАК ПОСІВНИЙ, ТОПІНАМБУР, додавати їх в усі салати, можна в перші або другі блюда.
ГРЕЙПФРУТ. Бажано 1-2 рази в день за 30 хвилин до й після прийому їжі пити по 1/2 склянки соку. Особливо це корисно при ГХ в клімактеричний період, як у чоловіків, так і в жінок.
Набір необхідних мікроелементів і вітамінів роблять ШПИНАТ ГОРОДНІЙ незамінним у лікуванні ГХ. Рекомендують при всіх захворюваннях ССС, особливо при ураженні капілярів, шпинат укріплює судинну стінку.
ФІАЛКА ТРИКОЛІРНАдобре знижує АТ. Відвар: 2 столові ложки сировини заливають 1 склянкою окропу. Настоюють 2 години у темному місці, перед уживанням проціджують. Приймають по 1/3 склянки за 30 хвилин до їжі 3 рази в день.
ЧОРНИЦЯмає виражену гіпотензивну властивість. У сезон варто з’їдати по 1/2-2/3 склянки ягід щодня.
Цефалгія – частий симптом при ДЕ, тому не кваптеся при головному болі призначати таблетки. Головний біль можуть полегшити багато засобів народної медицини.
Іноді причиною головного болю буває спазм мозкових судин, причиною якого євелика кількість газів,що утворилися в кишечнику, вони тиснуть на діафрагму, піднімають її, здавлюючи при цьому великікровоносні судини. У таких випадках незамінним буде ЕФІРНЕ ЛАВАНДОВЕМАСЛО. Приймають по 5 крапель на 1 столову ложку холодної кип’яченої води 2 рази в день через 20-30 хвилин після прийому їжі.
КРОПОВА ВОДА, яку можна легко приготувати в домашніх умовах: 1 столову ложку свіжого або 1 чайнуложку сухого кропу заливають 1 склянкою окропу, настоюють до охолодження. Приймають по 2 столові ложки 5-6 разів у день через 20 хвилин після їжі.
Знімає головний біль ЛЮБИСТОК ЛІКАРСЬКИЙ. Роблять компрес на область чола, скронь, потилиці зі свіжих листків любистку, попередньо розім’явши їх.Можна 2 столові ложки сухих листків залити 1/4 склянки окропу, а отриману кашку покласти на бавовняну серветку й зробити компрес.
Головний біль може зняти неміцно зварена КАВА приготована з МЕДОМ(на 1/2 склянки кави - 1/4 чайної ложки меду). П’ють по 1/2 склянки 3-4 рази в день, кава повинна бути гарячою.
Настій КОРИЦІ: 2 гсировини заливають 2/3 склянки не дуже гарячого окропу й підсолоджують медом або цукром. Настоюють 30 хв. П’ють по 2 ковтки через кожні 20-30 хвилин.Одночасно змочену настоєм марлю прикладають до чола й скронь.
Древній спосіб лікування: скроневі області змазують соком свіжонатертого ХРІНУ ЗВИЧАЙНОГОна 1—3 хвилини. Можна з’їсти шматочок житнього хліба з невеликою кількістю тертого хріну.
РОМАШКА АПТЕЧНА - ще Гіпократ застосовував її при головному болі. Зараз дуже популярнийчай з ромашки. Його п’ють із медом або вершками. Сухі квітки (5 г) заливають 1 склянкою окропу, настоюють15 хв. Якщо чай пити не тільки при головному болі, але й на ніч, буде прекрасний спокійний сон.
Щоб позбутися головного болю, необхідно вимити голову теплим відваром МАТЕРИНКИ ЗВИЧАЙНОЇ, а потім обов’язково пов’язати її хусткою. Відвар готують у такий спосіб: 4 столові ложки сировини насипають у посуд ємністю 2 л, краще глиняний, заливають 1 л сирої води, розмішують, накривають кришкою й залишають на ніч при кімнатній температурі.Ранком суміш ставлять на вогонь і кип’ятять 5-7 хвилин, знімають із вогню, залишають відкритою на 1/2 години, потім проціджують.Зберігають у прохолодному місці, при необхідності підігрівають.
При зниженому тонусі судин головного мозку і порушенні венозного відтоку призначають стимулятори: солодка, шипшина, алое з коротким курсом до 2-3 тижнів з наступним призначенням таких зборів:
а) плоди шипшини і глоду подрібненого, відповідно 4 і 3 частини, листки кропиви (3 частини), трава звіробою (1 частина);
б) плоди глоду (3 частини), шипшини (3 частини), аронії (відповідно, 2 частини), квітки календули (2 частини), трава череди і листки подорожника (по 2 частини).
Обидва збори готуються по єдиній схемі: 10 г суміші заливають 200 мл кип’ятку, настоюють в термосі 2 год, приймають по 100 мл 2 рази в день до їжі.
При підвищеному тонусі в артеріальному руслі призначають такі збори:
а) корінь валеріани, трава пустирника, плоди тмину і фенхеля ( в рівних частинах по 1 г) залити 200 мл кип’ятку, настояти 2 год, приймати по 70 мл 2-3 рази в день до їжі;
б) плоди глоду (10 г) подрібнюють і заливають 200 мл води, кип’ятять 10 хв, проціджують, приймають по 50 мл 2-3 рази в день до їжі.
При наявності атеросклеротичних змін в судинах призначають такі збори:
а) квітки ромашки, конвалії, плоди фенхеля, корінь валеріани, листки м’яти у співвідношенні 1:1:2:4:3;
б) корінь валеріани, трава меліси і тисячолисника, відповідно у співвідношенні 1:1:3.
Дані збори готують і приймають по такій схемі: 5 г суміші заливають 200 мл холодної води, настоюють при кімнатній температурі не менше 3 год, далі кип’ятять 10 хв, проціджують і приймають по 40-50 мл 3-4 рази в день.
Отже, арсенал немедикаментозної терапії хворих з ГДЕ досить широкий. Використання описаних методик може значно покращити стан пацієнтів і, що є найбільш важливим, зменшити необхідність у використанні медикаментів.
Контрольні питання до розділу.
Розділ 6. Медико-соціальна експертиза хворих з дисциркуляторною енцефалопатією та оцінка порушень життєдіяльності.
Не дивлячись на вище перерахований арсенал лікувальних заходів щодо ДЕ, захворювання має здатність до прогресування, часто причиною такого стану є психо-емоційне перенапруження, гіпокінезія, надлишкова маса тіла, зловживання алкоголем, остеохондроз шийного відділу хребта з синдромом хребтової артерії, супутні соматичні захворювання. В цілому можна виділити стабільний, повільно прогредієнтний (з пароксизмами та минущими порушеннями мозкового кровообігу і без судинних епізодів), інтермітуючий, швидко прогредієнтний перебіг. Стабільний та повільно прогредієнтний перебіг більш характерні для І ст. ДЕ, яка може тривати протягом 7-12 років. При швидкому прогредієнтному перебігу ІІ чи ІІІ ст. захворювання може розвинутись протягом 5 років. В ІІ ст. захворювання також можлива відносна стабілізація на фоні неврологічного дефіциту, хоча при повторних кризах і транзиторних ішемічних атаках характерна прогредієнтність. Для даної патології характерне наростання клінічних проявів, особливо з віком, що відображає також приєднання атеросклеротичного ураження судин та приєднання іншої соматичної патології. Більш швидкий темп прогресування психоневрологічних розладів характерний для АГ з несприятливим перебігом. Клінічний прогноз в ІІІ ст. ДЕ несприятливий.
Критеріями тимчасової втрати працездатності при ДЕ (Макаров А.Ю.,2006) є:
Тривалість тимчасової втрати працездатності залежить від стадії ДЕ, особливостей клінічної картини захворювання, професії та умов праці хворого.
Захворювання веде до обмеження життєдіяльності. Ступінь обмеження життєдіяльності залежить від особливостей неврологічного дефіциту, вираженості психічних порушень, визначається стадією ДЕ. В І ст. захворювання життєдіяльність обмежується частіше в зв’язку з порушенням адаптації до зовнішніх впливів (коливання атмосферного тиску, температури та ін.), фізичних та розумових перенапружень, побутових стресів і т.д. В ІІ, а особливо в ІІІ ст., ДЕ проявляється координаторними і руховими розладами (здатність до переміщення) різного ступеню. Пароксизмальні розлади, такі як криз чи транзиторна ішемічна атака, додатково обмежують життєдіяльність та працездатність хворих. Соціальна адаптація хворого затруднена, в зв’язку із зменшенням можливостей набуття нових знань. На пізніх стадіях захворювання, коли виникає деменція, порушується здатність до адекватної поведінки, потім втрачаються побутові навики, стає неможливим самообслуговування.
При медико-соціальній експертизі необхідно зауважити, що хворим з ДЕ протипоказані певні види роботи та умови праці, зокрема:
Однак, хворі часто залишаються працездатними, особливо в І і рідше в ІІ ст. ДЕ при сприятливому перебігу захворювання (відносній стабілізації, повільному прогресуванні) і задовільних результатах лікування; також при помірних порушеннях функцій, нечастих та легких минущих порушеннях мозкового кровообігу при раціональному працевлаштуванні або здійсненні обмежень в роботі.
Та в деяких випадках виникає ситуація, коли необхідне направлення пацієнтів на експертну комісію.
Покази для направлення на МСЕК (Макаров А.Ю.,2006):
Критерії інвалідності (Макаров А.Ю.,2006):
ІІІ група інвалідності показана при помірному порушенні життєдіяльності в І ст. ДЕ (при особливо несприятливих умовах праці) і в ІІ ст. ДЕ (по критерію обмеження здатності до трудової діяльності першого ступеня).
ІІ група – при значному обмеженню життєдіяльності, обумовленому неврологічними порушеннями, когнітивними дефектами, або повторними минущими порушеннями мозкового кровообігу та інсультами.
І група інвалідності показана при швидко прогресуючому перебігу хвороби, деменції, виражених порушеннях рухової функції, які різко обмежують життєдіяльність (по критеріям до самообслуговування та пересування третього ступеня).
Робота невролога полягає в попередженні виникнення інвалідності. На сьогоднішній день розглядають три види профілактики інвалідності – первинну, вторинну та третинну. Первинна профілактика полягає в необхідності врахування первинних факторів ризику для розвитку судинних захворювань та адекватне лікування хворих з початковими проявами недостатності мозкового кровообігу із врахуванням етіологічного чинника.
Вторинна профілактика – це раннє виявлення і цілеспрямоване лікування хворих з ДЕ, особливо в І ст. захворювання, виключення факторів, що сприяють прогресуванню захворювання, дотримання оптимальних термінів тимчасової непрацездатності після минущого порушення мозкового кровообігу та інсульту, диспансеризація хворих з ДЕ, а також проведення комплексу реабілітації у хворих, що перенесли інсульт.
Третинна профілактика включає в себе попередження декомпенсації в перебігу захворювання, особливо із-за несприятливих впливів виробничих факторів, своєчасне визначення ІІІ групи інвалідності та раціональне працевлаштування (профілактика прогресування захворювання), проведення заходів соціальної допомоги та захисту.
Отже, цереброваскулярна патологія знижує якість життя, призводить до інвалідності, тобто безпосередньо впливає на життєдіяльність хворого. В свою чергу, життєдіяльність людини відображається в наступних основних сферах: самообслуговування, спілкування, навчання, міжособистісні взаємовідносини, сімейне і громадське життя, мобільність.Для виміру порушень життєдіяльності і соціальних обмежень основними вимірювальними інструментами служатьтести, шкали і опитувачі.
При дослідженні інколи потрібно отримати узагальнену оцінку стану здоров’я пацієнта.По визначенню ВООЗ,здоров’я — це повне фізичне, соціальне і психологічне благополуччя людини, а не проста відсутність захворювань.
Для інтегральної оцінки стану здоров’я можуть бути використані різні шкали, тести і опитувачі, які дають всебічну характеристику здоров’я пацієнта.Відповідно, для оцінки стану здоров’я,повинні бути відображені принаймні 5основних аспектів, а саме:
1) фізичне здоров’я,
2) психічне здоров’я,
3) рівень незалежностів повсякденній життєдіяльності,
4) соціальне здоров’я,
5) економічне функціонування/забезпечення.
Фізичне здоров’я визначається фізичним станом, наявністю або відсутністю симптомів хвороб, рівнемфізичної діяльності. Оцінка фізичного здоров’я здебільшого ґрунтується на виявленні симптомів, характерних для певної хвороби, на виявленні і користуванні медичною допомогою.За допомогою опитувачів здебільшого стараються отриматиінформацію про самооцінку здоров’я в цілому, наявність симптомів певних захворювань, рівень активності, наявність хронічних захворювань, звернення за медичною допомогою, користування медичними послугами, вживання ліків.
Симптоми, про наявність яких опитуєтьсяхворий, відбираються в залежності від профілю патології, із приводу якої пацієнт проходить лікування. З’ясування симптомів служить для грубої оцінки стану здоров’я, скоріше відбиваючи наявність проблем, що хвилюють хворого і здатних послужити причиною звернення пацієнта за медичною допомогою. Самі по собі симптоми ще не дають інформації про ступінь порушенняфункціонування пацієнта.
Рівень активності пов’язанийзі станомздоров’я частіше визначають шляхомз’ясування числа днів обмеженої активності за визначений період часу, тобто число днів, коли опитуванийза станом здоров’я змушений був залишатися в ліжку, або не вийтина роботу, і т.д.
З’ясування наявності в людини діагностованихзахворювань, що єна момент опитування, або хронічних захворювань, що утруднюють нормальне функціонування, також може сприяти оцінці стану фізичного здоров’я. Для цієї ж мети служать питання про прийняті лікарські засоби, про частоту звернень за медичною допомогою, про госпіталізації з причин, пов’язаних з фізичним здоров’ям.
При оцінці психічного здоров’язвертають увагу на наявність або відсутність психічних розладів.
Оцінка повсякденної життєдіяльностівідмічає наступні питання: чи може хворий жити незалежно, чи може надання будь-якого виду послуг забезпечити його життя в звичайних умовах, або функціональна неспроможність пацієнта. Для цього використовуються шкали Незалежності у повсякденному житті (ADL) (Белова А.Н., 2004). Вперше термін «Activities of Daily Living» (ADL) ввів Deaver у 1945 р. Цей термін різними перекладачами тлумачиться по-різному: як „активність повсякденного життя”, як „функції повсякденної життєдіяльності”, як „повсякденна активність”. Під ADL здебільшого розуміють ті базові фізичні функції, що лежать в основі нормального життя, тобто функції, необхідні для елементарного самообслуговування.
Наводимо приклади деяких шкал, більш широко висвітлених у вище згаданому керівництві.
Оцінка клубу моторики: функціональна рухова активность. Шкала характеризує мобільність хворого в широкому понятті. Кожне завдання оцінюється по 4-х бальній системі, максимальний бал дорівнює 54, тобто норма (табл. 18 ).
Motor Club Assessment: functional movement activities
(по A.Ashburn, 1982; A.J.Turton, C.M. Fraser, 1986; D.Wade, 2000)
Бали
0= Неможливо (немає участі самого хворого, потрібна допомога двох і більше осіб)
1= Допомога (хворий приймає участь у виконанні завдання, потрібна допомога тільки однієї особи)
2= Незалежний при використанні допоміжних засобів
3= Незалежний
Х= Тестування не проводилося (вказати, з якої причини)
|
Бал |
Завдання |
Примітки |
||
|
______ |
З положення лежачи на спині переміститися в положення сидячи на лівому краю ліжка, спустивши ноги з ліжка |
Підтягування за край постелі рівносильно використанню допоміжних засобів |
||
|
______
|
З положення лежачи на спині переміститися в положення сидячи на правому краю ліжка, спустивши ноги з ліжка |
Підтягування за край постелі рівносильно використанню допоміжних засобів |
||
|
______
|
"Напівмісток" з положення лежачи на спині (підведення таза)
|
Використання здорової ноги для того, щоб допомогти ураженій нозі випрямитися, рівносильно використанню допоміжних засобів |
||
|
______
|
Втримати рівновагу в положенні сидячи (60 секунд) |
Упор руками рівносильний використанню допоміжних засобів |
||
|
______
|
Сісти на край ліжка, торкнутися ступнями підлоги і повернутися назад у положення лежачи |
Використання опори об руки рівносильно використанню допоміжних засобів |
||
|
______
|
Переміститися з положення сидячи в положення стоячи |
Використання опори об руки рівносильно використанню допоміжних засобів |
||
|
______
|
Втримати рівновагу в положенні стоячи на обох ногах (30 секунд)
|
Обидві ступні повинні доторкуватися підлоги. Використання опори об стілець, ціпок і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
Стояння на лівій нозі (5 секунд)
|
Використання опори об стілець, ціпок і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
Стояння на правій нозі (5 секунд)
|
Використання опори об стілець, ціпок і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
З положення стоячи сісти на підлогу
|
Використання опори об стілець, ціпок і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
Втримати рівновагу в положенні стоячи на колінах (10 секунд)
|
Використання опори об табуретку і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
Втримати рівновагу в положенні стоячи на одному коліні, лівому (10 секунд) |
Використання опори об табуретку і т.д. рівносильно використанню допоміжних засобів |
||
|
______
|
Втримати рівновагу в положенні стоячи на одному коліні, правому (10 секунд)
|
Використання опори об табуретку і т.д. рівносильно використанню допоміжних засобів
|
|
|
|
______
|
Встати з підлоги
|
Використання опори об табуретку і т.д. рівносильно використанню допоміжних засобів
|
|
|
|
______
|
Переміститися зі стільця, з положення сидячи, на ліжко, у положення лежачи
|
Використання опори об стілець, постіль, ціпок т.д. рівносильно використанню допоміжних засобів
|
|
|
|
______
|
Переміститися з ліжка, з положення лежачи, на стілець, у положення сидячи
|
Використання опори об стілець, постіль, ціпок т.д. рівносильно використанню допоміжних засобів
|
|
|
|
______
|
Хода (15 метрів) |
Відзначити час і використовувані допоміжні засоби |
|
|
|
______ |
Хода по сходам (підйом і спуск на 10 сходин) |
Відзначити час і використовувані допоміжні засоби |
|
|
|
______
|
ЗАГАЛЬНИЙ БАЛ |
|
|
|
Тест- оцінка клубу моторики: функціональнарухова активність характеризуємобільність хворого, тобто оцінює здатністьпереміщатися в ліжку, вставати, ходити, утримувати рівновагу. По чотирьохбальній системіоцінюється кожне завдання; максимальний бал, що дорівнює 54 (відповідаєнормі).
Міра функціональної незалежності(FunctionalIndependenceMeasure, або FIM, (табл. 19) - цешкалаінтегруючої оцінки порушеньжиттєдіяльності і рольових обмежень.
Таблиця 19.
Міра Функціональної Незалежності
FunctionalIndependenceMeasure(FIM)
(по С.Granderі cпівавт., 1979; СооkL. і cпівавт., 1994)
7-бальна шкала оцінки пунктів:
7 - повна незалежність у виконанні відповідної функції (усі дії виконуються самостійно, у загальноприйнятій манері і з розумними витратами часу)
6 - обмежена незалежність (хворий виконує всі дії самостійно, але повільніше, ніж здебільшого, або має потребу в сторонній допомозі)
5 - мінімальна залежність (при виконанні дій потрібне спостереження персоналу або допомога при надяганні протеза/ортеза)
4 - незначна залежність (при виконанні дій потребує сторонньої допомоги, однак більш 75% завдання виконує самостійно)
3 - помірна залежність (самостійно виконує 50—75% необхідних для виконання завдання дій)
2 - значна залежність (самостійно виконує 25—50% дій)
1 -повна залежність від навколишніх (самостійно може виконати менше 25% необхіднихдій)
|
|
Бланк для відповідей |
БАЛИ |
|
|
Самообслуговування |
|
|
|
Прийом їжі (користування столовими приладами, піднесення їжі до рота, жування, ковтання) |
_______ |
|
|
Особиста гігієна (чищення зубів, причісування, умивання обличчя і рук, гоління або макіяж) |
_______ |
|
|
Прийняття ванни/душу (миття і витирання тіла, за винятком області спини) |
_______ |
|
|
Одягання (включаючи надягання протезів/ортезів), верхня частина тіла (вище поясу) |
_______ |
|
|
Одягання (включаючи надягання протезів/ортезів), нижня частина тулуба (нижче поясу) |
_______ |
|
|
Туалет (використання туалетного паперу після відвідування туалету, гігієнічних пакетів) |
_______ |
|
|
Контроль функцій тазових органів |
|
|
|
Сечовий міхур (контроль сечовипускання і, при необхідності, використанняпристосувань для сечовипускання — катетера, і т.д.) |
_______ |
|
|
Пряма кишка (контроль акту дефекації і, при необхідності, використанняспеціальних пристосувань — клізми, калоприймальники і т.д.) |
_______ |
|
|
Переміщення |
|
|
|
Ліжко, стілець, інвалідне крісло (здатність вставати з ліжка і лягати на ліжко, сідати на стілець або інвалідне крісло і вставати з них) |
_______ |
|
|
Туалет (здатність користуватися унітазом — сідати, вставати) |
_______ |
|
|
Ванна, душ (здатність користуватися кабіною для душу або ванною) |
_______ |
|
|
Рухливість |
|
|
|
Хода/пересування за допомогою інвалідного крісла (балу„7”відповідаєможливість ходи без сторонньої допомоги на відстань не менш 50 метрів, балу„1”— неможливість перебороти відстань більш 17 метрів) |
_______ |
|
|
Підйом по сходах (балу„7”відповідає можливість підйому без сторонньої допомоги на 12—14 сходинок, балу„1”— неможливість перебороти висоту більш 4 сходинок) |
_______ |
|
|
РУХОВІ ФУНКЦІЇ: СУМАРНИЙ БАЛ |
_______ |
|
|
Спілкування |
|
|
|
Сприйняття зовнішньої інформації (розуміння мови і/або письма) |
|
|
|
Виклад власних бажань і думок (усним або письмовим способом) |
|
|
|
Соціальна активність |
|
|
|
Соціальна інтеграція (взаємодія з членами родини, медперсоналом і іншим оточенням) |
|
|
|
Прийняття рішень (уміння вирішувати проблеми, пов’язані з фінансами, соціальними й особистими потребами) |
|
|
|
Пам’ять (здатність до запам’ятовування і відтворення отриманої зорової і слуховой інформації, навчанню, впізнанню навколишніх) |
|
|
|
ІНТЕЛЕКТ: СУМАРНИЙ БАЛ |
|
Шкала FIMскладається з 18 пунктів: пункти 1-13 - відображають стан руховихфункцій;пункти 14-18 – відображають стан інтелектуальнихфункцій. Підраховується сума балів по всім пунктах опитувача. Пропуск пунктів не допускається; якщо яку-небудь функцію неможливо оцінити, то пункт оцінюється балом „1”. Сумарна оцінка може складати від 18 до 126 балів; чим вище сумарна оцінка, тим повнішанезалежність хворого в повсякденному житті.
Соціальне здоров’я - це вимір сімейнихі інших індивідуальних зв’язків й участі в житті суспільства. Соціальна участь і взаємодія здебільшого виявляються в 4-х сферах: родина і будинок (родинне становище, контакти з родичами), друзі і знайомі, відносини із соціальними організаціями і робота або основна діяльність для непрацюючого на службі.
Економічне забезпечення залежить, як правило, не тільки від стану здоров’я. Томубагатьма дослідниками не включається в узагальнену оцінку станухворого, так як вважається що безпосередньо до стану здоров'яне відноситься.
Останнім часом з’явились багатоаспектові опитувачі якості життя, наводимо деякі з них, які б були цікаві нашим читачам.
Європейський опитувач якостіжиття(EuroQualityofLife, або EuroQol, табл.20)складається з двох частин: перша відображає профіль здоров’я, друга – візуальну аналогову шкалу для глобальної оцінки Якості Життя, пов’язаної зі здоров’ям (WalkerS., RoserR., 1993; KindP., deCharroF., 1998). Це широко розповсюдженийбагатоаспектний опитувач, розроблений спільно групою дослідників з Великобританії, Нідерландів, Норвегії, Фінляндії і Швеції в 1990 р.Опитувач постійно допрацьовується, з’являлися нові версії.
Таблиця 20.
Європейський Опитувач Якості Життя- 5 напрямків
EuroQuality of Life – 5 Dimentions, абоEuroQol – SD
( поS.Walker, R.Roser, 1993; P.Kind, F. de Charro, 1998)
|
Мобільність |
||
|
|
У мене не виникає ніяких проблем з пересуванням |
|
|
|
У мене виникають деякі складнощі при пересуванні |
|
|
|
Я цілком прикутий до ліжка |
|
|
Самообслуговування |
||
|
|
У мене не виникає проблем із самообслуговуванням |
|
|
|
У мене деякі проблеми з умиванням або одяганням |
|
|
|
Я зовсім не можу самостійно митися або вдягатися |
|
|
Побутова активність |
||
|
|
У мене не виникає проблем з виконанням повсякденних звичних обов’язків (робота, навчання, ведення домашнього господарства, відпочинок) |
|
|
|
У мене є деякі проблеми з виконанням повсякденних звичних обов’язків |
|
|
|
Я зовсім не можу виконувати повсякденні звичні обов’язки |
|
|
Біль/Дискомфорт |
||
|
|
Я не відчуваю болів або дискомфорту |
|
|
|
Я відчуваю помірні болі або дискомфорт |
|
|
|
Я відчуваю надзвичайні болі або дискомфорт |
|
|
Тривога/Депресія |
||
|
|
Я не відчуваю тривоги або депресії |
|
|
|
Я відчуваю помірну тривогу або депресію |
|
|
|
Я відчуваю надзвичайну тривогу або депресію |
|
Опитувач заповнюється самим хворим, це не вимагає великих витратчасу. Важливо попередити пацієнта,щоне буває „правильных”або „неправильных”відповідей.
Врезультахтестування відзначений перший пункт з будь-якого з розділу тесту кодується цифрою 1, другий пункт -цифрою 2, третій -цифрою 3. Наприклад, „профиль”хворого, що відзначив 2-йпункт у розділах Мобільність і Самообслуговування, 1-й пункт у розділах Побутова активністьі Біль/Дискомфорт, 3-йпункт у розділі Тривога/Депресія, буде виглядатив такий спосіб: 22113.
Бал Стану Здоров’я(рис. 3)– це відображення результатів тестування у виді єдиного цифрового значення.Перша частина тесту вираховується за допомогою спеціальних таблиць.
Друга частина тесту представляєнамальовану шкалу (типу термометра), на якій найкращий стан здоров’я, яке тільки може уявитидля себе випробуваний, відповідає оцінці 100, а найгірше — оцінці 0.
|
|
Рисунок 12. «Термометр здоров’я» (по S.Walker, R.Roser, 1993)
Контрольні питання до розділу.

Standard Location of 14 Meridian's Points
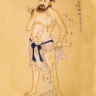
Video on YouTube
Video on YouTube
Video on YouTube